Гипохлорит натрия для дезинфекции. Формула гипохлорита натрия структурная химическая
Гипохлорит натрия - NaClO, получают хлорированием водного раствора сухого натра (NaOH) или электроидом раствора сухого натрия (NaCl). Молекулярная масса NaClO (по международным атомным массам 1971 г.) - 74,44. Промышленностью выпускается в виде водных растворов различной концентрации.
Водные растворы гипохлорита натрия (ГХН) стали использоваться для дезинфекции с самого зарождения хлорной промышленности. Благодаря высокой антибактериальной активности и широкому спектру действия на различные микроорганизмы, это дезинфицирующее средство находит применение во многих направлениях человеческой деятельности, в том числе и при обработке воды.
Дезинфицирующее действие ГХН основано на том, что при растворении в воде он точно так же, как хлор при растворении в воде, образует хлорноватистую кислоту, которая оказывает непосредственное окисляющее и дезинфицирующее действие.
NaClO+H2O-NaOH+HСlO
Реакция является равновесной, и образование хлорноватистой кислоты зависит от величины рН и температуры воды.
В РФ состав и свойства ГХН, выпускаемого промышленностью, или получаемого непосредственно у потребителя в электрохимических установках, должен соответствовать требованиям, предъявляемым в (3,4). Основные характеристики растворов ГХН, регламентируемые этими документами, приведены в таб.1.
Таблица 1. Основные физико-химические показатели растворов гипохлорита натрия, выпускаемых в РФ (3, 4)
| Наименование показателя | Норма для марок | ||||||
| По (3) | По (4) | ||||||
| Марка А | Марка Б | Марка А | Марка Б | Марка В | Марка Г | Марка Э | |
| 1.Внешний вид | Жидкость зеленовато-желтого цвета | Бесцветная жидкость | |||||
| 2.Коэффициент светопропус- кания, %, не менее | 20 | 20 | Не регламентируется | Не регламентируется | |||
| 3.Массовая концентрация активного хлора, г/дм3, не менее | 190 | 170 | 120 | 120 | 190 | 120 | 7 |
| 4.Массовая концентрация щелочи в пересчете на NaOH, г/дм3 | 10-20 | 40-60 | 40 | 90 | 10-20 | 20-40 | 1 |
| 5.Массовая концентрация железа, г/дм3, не более | 0,02 | 0,06 | Не регламентируется | Не регламентируется | |||
Примечания:
Для растворов по (3) допускается потеря активного хлора по истечении 10 суток со дня отгрузки не более 30% первоначального содержания и изменение окраски до красновато-коричневого цвета.
Для растворов по (4) допускается потеря активного хлора по истечении 10 суток со дня отгрузки для марок А и Б не более 30% первоначального содержания, для марок В и Г - не более 20%, для Марки Э - не более 15%.
В соответствии с (3-5) растворы гипохлорита натрия различных марок применяют:
раствор марки А по (3) - в химической промышленности, для обеззараживания питьевой воды и воды плавательных бассейнов, для дезинфекции и отбелки;
раствор марки Б по (3) - в витаминной промышленности, как окислитель для отбеливания ткани;
раствор марки А по (4) - для обеззараживания природных и сточных вод в хозяйственно-питьевом водоснабжении, дезинфекции воды рыбохозяйственных водоемов, дезинфекции в пищевой промышленности, получения отбеливающих средств;
раствор марки Б по (4) - для дезинфекции территорий, загрязненных фекальными сбросами, пищевыми и бытовыми отходами; обеззараживании сточных вод;
раствор марки В, Г по (4) - для дезинфекции воды рыбохозяйственных водоемов;
раствор марки Э по (4) - для дезинфекции аналогично марка А по (4), а также дезинфекции в медико-санитарных учреждениях, предприятиях общественного питания, объектах ГО и др., а также обеззараживание питьевой воды, стоков и отбеливания.
Необходимо отметить, что для изготовления растворов гипохлорита натрия марок АБ по (3) и растворов марки А по (4) не допускается применение абгазного хлора от хлорпотребляющих органических и неорганических производств, а также едкого натра, полученного ртутными методами.
Растворы марки Б по (4) получают из абгазного хлора стадии снижения производства хлора органических и неорганических производств и диафрагменного или ртутного едкого натра.
Растворы марок В и Г по (4) получают из абгазного хлора стадии снижения производства хлора и диафрагменного едкого натра с добавлением стабилизирующей добавки - цитраля сорта "Парфюмерный" по (6).
Растворы марки Э по (4) получают электролизом раствора поваренной соли.
Требования безопасности и охраны окружающей среды при работе с растворами гипохлорита натрия
Растворы гипохлорита натрия по (3) и марок А, Б, В, и Т по (4) являются сильными окислителями, при попадании на кожу могут вызвать ожоги, а при попадании в глаза - слепоту. Раствор гипохлорита натрия марки Э по (4) оказывает умеренно раздражающее действие на кожные покровы и слизистые оболочки. Кумулятивными,. кожно-резорбтивными свойствами и сенсибилизирующим действием не обладает; по уровню токсичности этот раствор относится к малоопасным веществам 4го класса опасности по (7).
При нагревании выше 35оС гипохлорит натрия разлагается с образованием хлоратов и выделением хлора и кислорода. ПДК хлора в воздухе рабочей зоны 1 мг/м3 ; в воздухе населенных мест 0,1 мг/м3 максимальная разовая и 0,03 мг/м3 среднесуточная (7).
Гипохлорит натрия негорюч и невзрывоопасен. Однако гипохлорит натрия по (3) и марок А, Б, В, и Г по (4) в контакте с органическими горючими веществами (опилки, ветошь и др.) в процессе высыхания может вызвать их самовозгорание. При попадании на окрашенные предметы гипохлорит натрия всех марок может вызвать их обесцвечивание.
Помещение для производства и применения гипохлорита натрия по (3) и марок А, Б, В и Г по (4) должны быть оборудованы принудительной приточно-вытяжной вентиляцией. Оборудование должно быть герметичным.
Индивидуальная защита персонала должна осуществляться с применением специальной одежды в соответствии с (8) и индивидуальных средств защиты: противогазов марки Б или БКФ по (9), перчаток резиновых и очков защитных по (10).
При попадании раствора гипохлорита натрия на кожные покровы необходимо обмыть их обильной струей воды в течение 10-12 мин., при попадании брызг продукта в глаза следует немедленно промыть их обильным количеством воды и направить пострадавшего к врачу.
Разлитый продукт по (3) и марок А, Б, В, и Г по (4) необходимо смыть большим количеством воды. При проливе гипохлорита натрия марки Э (4) необходимо собрать его при помощи тряпки или смыть водой и протереть. Ткань промыть водой.
Сточные воды, содержащие гипохлорит натрия, должны направляться на станцию нейтрализации.
Гипохлорит натрия в полиэтиленовых и стеклянных емкостях должен храниться в неотапливаемых вентилируемых складских помещениях. Гипохлорит натрия не допускается хранить с органическими продуктами, горючими материалами и кислотами.
Использование растворов гипохлорита натрия при обработке воды
Многолетняя практика использования растворов гипохлорита натрия для обработки воды, как в нашей стране, так и за рубежом показывает, что эти реагенты могут использоваться в широком диапазоне:
Для обработки природных и сточных вод в системе хозяйственно-питьевого водоснабжения, для дезинфекции воды в плавательных бассейнах и водоемах различного назначения, при обработке бытовых и промышленных сточных вод и др. В связи с тем, что этой проблеме посвящены многие тома публикаций, ниже рассматриваются сведения, приведенные в обзорных материалах (1, 11, 12).
Использованиерастворов ГХН для обработки питьевой воды
Использование растворов гипохлорита натрия предпочтительно на стадии предварительного окисления и для стерилизации воды перед подачей ее в распределительную сеть. Обычно в систему водоочистки растворы ГХН вводят после разбавления примерно в 100 раз. При этом, помимо снижения концентрации активного хлора, снижается также величина рН (с 12-13 до 10-11), что способствует повышению дезинфицирующей способности раствора. Помимо значения рН на дезинфицирующие свойства раствора оказывают температура и содержание свободного активного хлора. В табл. 2 приведены данные по избытку свободного активного хлора, необходимому для полной стерилизации при различных температурах, времени воздействия и величине рН питьевой воды.
При обработке питьевой воды остаточное содержание активного хлора допускается в пределах 0,3-0,5 мг/дм 3 . При этом доза активного хлора, вносимая в воду, может быть значительно выше и зависит от хлорпоглощаемости воды (табл. 3).
Таблица 2. Данные по избытку активного хлора, необходимые для полной стерилизации питьевой воды, при различных температурных, времени воздействия и величине рН (1)
| Температура воды, оС | Время воздействия, мин. | Требуемый избыток хлора, мг/дм 3 | ||
| РН 6 | рН 7 | рН 8 | ||
| 10 | 5 | 0,50 | 0,70 | 0,120 |
| 10 | 0,30 | 0,40 | 0,70 | |
| 30 | 0,10 | 0,12 | 0,20 | |
| 45 | 0,07 | 0,07 | 0,14 | |
| 60 | 0,05 | 0,05 | 0,10 | |
| 20 | 5 | 0,30 | 0,40 | 0,70 |
| 10 | 0,20 | 0,20 | 0,40 | |
| 15 | 0,10 | 0,15 | 0,25 | |
| 30 | 0,05 | 0,06 | 0,12 | |
| 45 | 0,04 | 0,04 | 0,08 | |
| 60 | 0,03 | 0,03 | 0,06 | |
Таблица 3. Некоторые данные об использовании гипохлорита натрия при обработке воды (11)
| Технологический процесс | Величина активного хлора, вносимого в воду, мг/дм 3 | Регистрируемое остаточное содержание активного хлора, мг/дм 3 |
| 1 | 2 | 3 |
| 1.Обеззараживание питьевой воды и очистка промышленных стоков | ||
| 1.1.Хлорирование питьевой воды | 3-10 | 0,3-0,5 |
| 1.2.Дезинфекция трубопроводов, резервуаров чистой воды, баков водонапорных башен | 75-100 | 0,3-0,5 |
| 1.3.Обезвреживание бытовых сточных и шахтных вод. | 5-10 | 1,5 (не менее) |
| 1.4.Обеззараживание циансодержащих стоков. | 50*10 3-100*10 3 | |
| 2.Борьба с болезнями рыб | ||
| 3.Железнодорожный и морской транспорт. | ||
| 3.1.Обезвреживание воды на железных дорогах. | 5 | |
| 3.2.Обезвреживание сточных вод на железных дорогах. | 10 | |
| 3.3.Хлорирование воды в грузовых танках судов. | 15 | |
| 4.Система бытового обслуживания населения. | ||
| 4.1.Дезинфекция емкостей питьевой воды. | 750-1000 | |
| 4.2.Обеззараживание воды в плавательных бассейнах | 3-10 | 0,3-0,5 |
Использование растворов ГХН для обработки воды плавательных бассейнов
Использование растворов ГХН для дезинфекции воды плавательных бассейнов и прудов позволяет получать чистую прозрачную воду, лишенную водорослей и бактерий. При обработке бассейнов растворами ГХН необходимо тщательно контролировать содержание активного хлора в воде. Важное значение имеет также поддержание РН на определенном уровне, обычно 7,4-8,0, а еще лучше 7,6-7,8.Регулирование рН осуществляется введением специальных добавок, например, соляной кислоты.
Как и в случае обработки питьевой воды, содержание остаточного хлора в воде плавательных бассейнов должно находиться на уровне 0,3-0,5 мг/дм 3 . Надежное обеззараживание в течение 30 мин. Обеспечивают растворы, содержащие 0,1-0,2% гипохлорита натрия. При этом содержание активного хлора в зоне дыхания не должно превышать 0,1 мг/м 3 в публичных плавательных бассейнах и 0,031 мг/м 3 в спортивных бассейнах. Следует отметить, что замена газообразного хлора гипохлоритом натрия приводит к снижению выделения хлора в воздух и, кроме того, позволяет легче поддерживать остаточное количество хлора в воде.
Использование растворов ГХН для обработки сточных вод
Гипохлорит натрия широко применяется для обработки бытовых и промышленных сточных вод для разрушения животных и растительных микроорганизмов; устранения запахов (особенно образующихся из серосодержащих веществ); обезвреживания промышленных стоков, в том числе содержащих цианистые соединения. Он может быть использован также для обработки воды, содержащей аммоний, фенолы и гуминовые вещества. В последнем случае могут образовываться хлороформ, дихлор - и трихлоруксусная кислоты, хлоральгураты и некоторые другие вещества, концентрация которых в воде значительно ниже.
Гипохлорит натрия также используется для обезвреживания промышленных стоков от цианистых соединений; для удаления сточных вод ртути, а также для обработки охлаждающей конденсаторной воды на электростанциях (в последнем случае используется мало концентрированный гипохлорит натрия марки Э по (1).
Некоторые данные о необходимом содержании активного хлора в воде, при использовании для ее обработки растворов гипохлорита натрия приведены в табл. 3. Конкретная доза раствора ГХН при обработке воды определяется исходя из данных этой таблицы и свойств применяемого раствора (см. табл.1).
Раствор гипохлорита натрия используется также и во многих других отраслях народного хозяйства, но эти случаи применения в данном обзоре не рассматриваются.
ОПРЕДЕЛЕНИЕ ОСНОВНЫХ ХАРАКТЕРИСТИК РАСТВОРОВ ГИПОХЛОРИТА НАТРИЯ
Исследованию подвергались три образца растворов гипохлорита натрия.
Образец №1 - импортный раствор ГХН представленный для испытания фирмой "ДиЭл Проспектен".Изготовитель - фирма "Bayer" (Германия).Ориентировочный срок изготовления: июнь-июль 2001 года.
Образец №2 - раствор марки А по (3) из партии, изготовленной ОАО "Синтез" по технологии компании "ДиЭл Проспектен" 5 сентября 2001 года.
Образец №3 - раствор, полученный хлорированием промышленного раствора едкого натра, по содержанию активного хлора превышающий марку А по (4). Изготовлен в период между 5 и 8 сентября 2001 года.
2.1.Определение исходного состава растворов гипохлорита натрия.
В соответствии с (3) определялись следующие основные характеристики сравниваемых растворов:
- внешний вид;
- коэффициент светопропускаемости, %;
- массовая концентрация активного хлора, г/дм 3 ;
- массовая концентрация щелочи в пересчете на NaOH, г/дм 3 ;
- массовая концентрация железа, г/дм 3 ;
Для более полной характеристики исследуемых растворов ГХН дополнительно определялись:
Результаты определения основных показателей качества исследованных растворов приведены в табл.4.
2.2.Определение скорости разложения растворов ГХН
Определение скорости разложения гипохлоритных растворов определялась двумя способами:
- При комнатной температуре (для образцов №1 и 2). При этом одна проба каждого образца ГХН хранилась в естественных условиях (днем - на свету), а вторая проба - постоянно в темноте.
- При температуре 55 о С (скорости испытания). В этом случае длительность испытания 7 час. Соответствует длительности хранения в темноте равной 1 году.
Результаты определения скорости разложения растворов ГХН при комнатной температуре приведены в табл.5. Данные о скорости разложения растворов ГХН всех трех образцов при температуре 55 оС приведены в табл.6. К сожалению, испытания образца №3 были прекращены преждевременно (отключение электроэнергии из-за аварии на электрораспределительной подстанции).Однако полученные данные позволили рассчитать процент раствора ГХН №3 за период испытаний 3часа, то есть, около 4месяцев хранения при комнатной температуре (данные приведены в табл. 4 в скобках).
Таблица 5. Экспериментальные данные о скорости разложения гипохлорита натрия при комнатной температуреТаблица 5. Экспериментальные данные о скорости разложения гипохлорита натрия при комнатной температуре
| Дата анализов | Образец №1 | Образец №2 | ||||||||||
| Хранение на свету | Хранение в темноте | Хранение на свету | Хранение в темноте | |||||||||
| Содер- жание АХ, г/ дм3 | Процент разложения, % | Содер- жание АХ, г/ дм3 | Процент разложения, % | Содер- жание АХ, г/ дм3 | Процент разложения, % | Содер- жание АХ, г/ дм3 | Процент разложения, % | |||||
| От исход-ного | От преды-дущего | От исход-ного | От преды-дущего | От исход-ного | От преды-дущего | От исход-ного | От преды-дущего | |||||
| 07.09.01г. | 120,0 | 120,0 | 186,0 | 186,0 | ||||||||
| 11.09. | 117,1 | 2,42 | 2,42 | 117,1 | 2,42 | 2,42 | 172,9 | 7,04 | 7,04 | 176,0 | 5,38 | 5,38 |
| 14.09. | 112,1 | 6,58 | 4,27 | 115,1 | 4,08 | 1,71 | 169,0 | 9,14 | 2,25 | 169,0 | 9,14 | 3,98 |
| 19.09. | 110,0 | 8,33 | 1,87 | 112,0 | 6,66 | 2,69 | 159,7 | 14,14 | 5,50 | 163,0 | 12,36 | 3,55 |
| 22.09. | 107,3 | 10,58 | 2,45 | 112,0 | 6,66 | 0 | 157,0 | 15,59 | 1,69 | 160,0 | 13,98 | 1,84 |
Таблица 6. Данные о скорости разложения гипохлорита натрия при температуре 55 о С
Примечание: В скобках указана величина разложения в пересчете на длительность испытаний в 3 часа.
Оценка исходного качества импортного раствора ГХН
Оценка исходного содержания активного хлора (АХ) и хлорида натрия в импортном растворе ГХН производилась из следующих соображений:
- По данным заказчика партия гипохлорита натрия поступила из-за рубежа в конце июля с.г. Учитывая, что какое-то, может быть и небольшое время, продукт находился на складе изготовителя и транспортировался, то по состоянию на время измерений 05.09.01г.) общее время его хранения и транспортировки было примерно равно 60 суткам.
- По результатам двухнедельных испытаний на стабильность, приведенным в табл., было принято,что потеря активного хлора за эти 60 суток составляла в среднем 120-109,65
= 0,69 г/дм 3 в сутки.
(среднее значение для случаев хранения на свету и в темноте).
- Из этих соображений было рассчитано первоначальное содержание активного хлора в импортном продукте, равное
120+0,69*60=161,4 г/дм 3
Принимая, что разложение гипохлорита натрия происходит, в основном, по реакции
2NaClO -2NaCl+O2
можно оценить исходное содержание в исходном растворе ГХН хлорида натрия из следующих соображений.На 1г-моль NaClO (74,5) при его разложении образуется 1г-моль хлорида натрия (58,5). Таким образом коэффициент пересчета составляет 0,785. Отсюда исходное содержание хлорида натрия в продукте составляет 179-0,785*0,69*74,5/51,5*60=179-47=132 г/дм 3
Полученные величины близки к значениям активного хлора и хлорида натрия в растворе гипохлорита натрия, изготовленном на ОАО "Скоропусковский опытный завод" (см.табл. 4).
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Сравнение качества исследованных растворов ГХН
Прежде всего обращает на себя внимание резкое различие между образцами растворов №1 и №2 по внешнему виду. Светложелтый импортный продукт соответственно имеет высокий коэффициент светопропускаемости (98%), а продукт производства ОАО "Синтез", представляющий собой слабопрозрачную жидкость темнокрасного цвета, имеет коэффициент светопропускаемости 31%. Как следует из данных, приведенных в табл.4, это напрямую связано с содержанием в растворах железа. По данным (2) предельно допускаемое содержание железа в растворах ГХН не должно превышать 0,005 мг/дм 3 .Поэтому раствор производства ОАО "Синтез", хотя он по этому показателю соответствует требованиям действующего нормативного документа (см. Табл. 1), далее отстает от требований, предъявляемых к гипохлориту натрия как к химическому продукту, имеющему высокие служебные свойства.
Раствор гипохлорита натрия производства ОАО СОЗ (образец№3) по данному показателю близок к импортному: цвет - светложелтый, коэффициент светопропускания - 88%. Содержание железа в этом растворе составляет 0,0047 мг/дм 3 , что соответствует требованиям, приведенным в (г). Присутствие в растворе ГХН железа снижает его стабильность. Об этом в частности, свидетельствуют данные о скоростях разложения исследованных растворов ГХН, приведенных в табл. 5 и 6.Их значения для образцов №1 и 3 значительно ниже, чем для образца №2, но очень близки между собой. Из этого можно сделать однозначный вывод о том, что требования к растворам ГХН по (3) значительно уступают требованиям к служебным свойствам растворов, требуемых промышленность и основаны на возможностях технологий, принятых на предприятиях - изготовителях бывшего СССР и находившихся, как известно, на низком уровне.
Исходное содержание активного хлора в образцах растворов ГХН №1 и 3 меньше чем в образце №2. При этом содержание в них хлорида натрия соответствует стехиометрическому. В то же время в образце №2, в котором содержание активного хлора примерно в 1,16 раза больше, чем в образцах №1 и 3, содержание хлорида натрия в 1,21 раза выше стехиометрического соотношения (177 г/ дм 3 вместо 146 г/ дм 3), что дополнительно свидетельствует о низком уровне культуры производства, в частности, отсутствии контроля за уровнем температуры технологического процесса.
Таким образом, можно сделать вывод, что гипохлорит натрия, изготовленный на СОЗ по технологии компании "ДиЭл Проспектен" (образец №3) практически аналогичен импортному продукту _ гипохлориту натрия фирмы "Bayer" (Германия). Более того, несмотря на отсутствие специальных консервирующих добавок гипохлорит натрия (образец №3) является более стабильным, чем немецкий и срок его гарантированного хранения превосходит немецкий на два - три месяца.
Исследовательская группа
ГОСНИИ "Хлорпроект"
В водных растворах гипохлориты способны разлагаться довольно быстро – однако будет зависеть от температуры воды и ее РН. Сильнокислые растворы полностью гидролизуют гипохлориты, разлагая их при комнатной температуре до кислорода и хлора. Нейтральная среда превращает гипохлориты в хлораты и хлориды – при этом реакция замедляется в условиях комнатной температуры и ускоряется при ее повышении. Температура выше 70оС существенно ускоряет процесс разложения и используется в промышленности для получения хлоратов.
Гипохлориты представляют собой сильные окислители, однако их окисляющие способности в водном растворе сильно зависят от его РН-среды.
Гипохлориты, помещенные в щелочной раствор, входят в реакцию с перекисью водорода, образовывая хлорид и кислород. Основная особенность данной реакции в высвобождении кислорода, находящегося в возбужденном синглетном состоянии, а не в основном триплетном. Именно это и является предпосылкой для его высокой активности и фосфоресцирования в ближнем инфракрасном диапазоне.
Применение гипохлоритов
В органическом синтезе алкилгипохлориты подвергают термической или фотохимической изомеризации с целью получения δ-хлоргидринов. При реакции Гофмана амиды кислот взаимодействуют с гипохлоритами и группируются внутри молекул в изоцианаты, впоследствии гидролизующиеся до первичных аминов или образовывающие уретаны (при наличии ).
Первым гипохлоритом, который начали использовать в промышленности, был гипохлорит калия, применявшийся в отбелке целлюлозной ткани.
Гипохлориты кальция и натрия – это крупнотоннажные продукты, которые получают в результате пропускания хлора через суспензию или раствор соответствующего гидроксида. Большинство гипохлоритов, произведенных по данному методу, используется в смеси с определенным хлоридом – например, гипохлорит, смешанный с хлоридом кальция, превращается на выходе в хлорную известь.
Низкая стоимость и сильные позволяют применять гипохлориты в качестве отбеливающего средства в бумажной, текстильной и целлюлозной промышленности. Кроме того, их используют для дегазации фосфорорганических и серосодержащих ядовитых веществ, а также для химической дезинфекции сточных и питьевых вод.
Кислоты, в состав которых входит хлор, достаточно разнообразны. Всего их можно выделить пять:
Каждая из них - сильнейший окислитель, который имеет широкий спектр действия и поэтому достаточно широко используется в различных химических синтезах и промышленности. Однако особое значение имеет самая слабая из них, но при этом по окисляющим способностям не уступающая другим - хлорноватистая. Одна из ее солей, натрий гипохлорит, входит в сто самых синтезируемых и важных химических соединений для использования в быту. Почему и с чем это связано, попробуем разобраться.
Хлорноватистая кислота и ее соли
Как уже было обозначено, данная кислота не самая сильная среди своих коллег. Однако именно она способна легко высвобождаться из своих солей и проявлять сильнейшие антибактериальные, окислительные и дезинфицирующие свойства. Это и определяет основные области ее применения и подчеркивает важное значение.
Так как сама кислота достаточно нестабильна, то экономически выгоднее и удобнее применять ее соли. Самые распространенные из них в промышленности, это:
- гипохлорит калия;
Все они при обычных условиях - твердые кристаллические вещества, способные при небольшом нагревании разлагаться, с высвобождением свободного хлора. При правильной транспортировке, хранении и использовании являются незаменимыми помощниками в промышленности, хозяйстве и медицине.
Наибольшее значение имеет именно гипохлорит натрия, поэтому его рассмотрим подробнее.
Формула натрия гипохлорита
Если рассматривать особенности состава молекулы, то количественное соотношение элементов будет таким:
- натрий - 31%;
- хлор - 48%;
- кислород - 21%.
Эмпирическая формула гипохлорит натрия имеет вид NaCLO. Положительно заряженный ион натрия связывается ионными взаимодействиями с хлорит-ионом. Связи внутри последнего образованы по ковалентному полярному механизму: шесть электронов хлора по парам и один неспаренный объединяется с одним электроном атома кислорода. Общий заряд иона CLO - .
Очевидно, что формула гипохлорит натрия отражает и строение его молекулы, и ступени диссоциации в водном растворе. Также демонстрирует качественный и количественный состав соединения.

История открытия и использования вещества
На самом деле данная история берет свое начало с XVIII века. Ведь именно тогда, в 1774 году, Карлом Шееле был открыт элементарный (молекулярный) хлор. В течение многих лет изучались его свойства. Поэтому только в 1787 году Клод Бертолле сумел обнаружить, что если данный газ растворить в воде, то получиться смесь кислот, способная давать потрясающий отбеливающий и дезинфицирующий эффект.
Эту смесь назвали белильной жидкостью и наладили массовое производство. Однако буквально в этом же году стало понятно, что в такой форме хранить и транспортировать это вещество нецелесообразно, так как оно быстро разлагается под действием ряда факторов:
- температуры;
- освещения;
- попадания инородных частиц;
- просто на открытом воздухе и прочее.
Поэтому способ получения был модернизирован. Стали пропускать едкий газ хлор не через воду, а через раствор поташа. В результате образовывался более стабильный продукт KCLO, который обладал теми же свойствами при использовании. Данное соединение назвали "жавелевая вода" и стали широко применять для бытовых нужд.
Но поташ, или карбонат калия, - это достаточно дорогая соль. Поэтому с экономической точки зрения данный способ был не слишком выгодным. Тогда в 1820 году Антуан Лабаррак догадался заменить поташ на более дешевую и общедоступную соль - каустическую соду. Это решило проблему. В результате стали получать продукт, который используется до сих пор - натрий гипохлорит NaCLO.
Сегодня существует несколько синонимов названию для этого соединения:
- жавелевая вода;
- лабарракова вода;
- гипохлорит натрия;
- натрий хлорноватистокислый.
Физические свойства
По своим физическим параметрам это соединение ничем не отличается от других солей хлорноватистой кислоты. Можно выделить несколько основных характеристических черт.
- По внешнему виду при обычных условиях это бесцветные кубические кристаллы, имеющие слабый едкий запах хлора.
- Легко и полностью растворяются в воде в больших количествах, дают щелочную реакцию среды.
- Температура плавления кристаллов - 18-24 0 С.
- Температура замерзания зависит от концентрации раствора и колеблется в пределах от -1 0 С до -30 0 С.
- При нагревании свыше 30 0 С вещество разлагается с высвобождением свободного хлора, при более высоких температурах разложение происходит со взрывом.
- Гипохлорит натрия плотность имеет равную 1250-1265 кг/м³.
- При нахождении на открытом воздухе кристаллы способны самопроизвольно плавиться, переходя в жидкое состояние.
- Водный раствор имеет бледно-зеленую окраску, выражен запах хлора. Легко разлагается при внешнем воздействии и попадании посторонних предметов в емкость.
- Может выделять токсичный хлор, опасен при попадании в глаза и длительном воздействии на кожу. Сильный окислитель.

Таким образом, мы видим, что лабарракова вода - стабильное соединение только при соблюдении всех условий хранения. Поэтому обращаться с ним и использовать следует очень осторожно.
Формы существования
Рассматриваемое нами вещество существует в форме трех кристаллогидратов.
- Моногидрат . Химическая формула NaOCL*H 2 O. Данная форма не является устойчивой, способна взрываться при температуре выше 60 0 С.
- При более высоком содержании воды в составе молекулы устойчивость повышается. Следующий кристаллогидрат имеет вид NaOCL*2,5H 2 O. Не взрывается, при температуре выше 50 0 С плавится.
- Пентагидрат с формулой NaOCL*5H 2 O - самая устойчивая форма, которая и применяется в быту. Именно для нее были описаны вышеперечисленные физические свойства.
Натрий гипохлорит в водном растворе можно выделить выпариванием. Образуются бледно-зеленые или почти прозрачные игольчатые кристаллы пентагидрата.
Химические свойства
Данные характеристики базируются на окислительной способности рассматриваемого соединения. Самые главные типы реакций, в которых жавелевая вода способна принимать участие, следующие:
- Разложение. В зависимости от условий могут получаться разные продукты. При обычных условиях это поваренная соль и кислород. При нагревании - хлорат натрия и поваренная соль. При действии кислот реакция проходит с выделением свободного хлора.
- Сильные окислительные свойства со всеми восстановителями. Способна преобразовывать сульфиты в сульфаты, нитриты в нитраты, растворять фосфор и мышьяк, с образованием их кислот, а также переводить аммиак в молекулу гидразина.
- При реакциях с металлами способствует увеличению их степени окисления до максимально возможной.
- Обладает сильными коррозионными свойствами, поэтому не может применяться для обработки металлических изделий.

Очевидно, что химические свойства рассматриваемого вещества сводятся к одному - это окислительное воздействие.
Производство гипохлорита натрия
Возможно получение жавелевой воды в лаборатории или же промышленности. Способы различаются. Рассмотрим оба варианта.
Получение гипохлорита натрия в промышленности.
- Способ, который был предложен еще в 1820 году Лабарраком, остается актуальным по сей день. Пропусканием хлора через раствор гидроксида натрия получают необходимый продукт. Данный вариант называется химическим.
- Электрохимический. Заключается в подвергании электролизу раствора NaCL или морской воды.
Оба используются сегодня и обеспечивают большие объемы продукта на производствах.

Лабораторные методы синтеза заключаются в получении небольших порций продукта. Они заключаются в пропускании хлора через раствор каустика или карбоната натрия.
Использование в промышленности
Самая главная отрасль народного хозяйства, в которой применяется данное вещество - это водоснабжение. Уже много лет, с начала XX века, используется обеззараживание воды гипохлоритом натрия. Почему это настолько актуально и применимо? На это есть ряд причин.
- Данный способ считается экологически чистым и безопасным, ведь при естественном разложении гипохлорита выделяется кислород и образуется поваренная соль, что не представляет никакой угрозы для природы и человека.
- Это самый эффективный метод борьбы с подавляющим числом бактерий, вирусов и грибков, а также простейших, вызывающих патологии.
- С экономической точки зрения данный способ самый выгодный и дешевый.

Сочетание всех обозначенных факторов позволяет считать гипохлорит натрия идеальным на сегодняшний день веществом для обработки питьевой воды. Также производится очистка воды в бассейнах и других искусственных водоемах. Можно вычищать аквариумы, обеспечивая рыбам комфортное существование и свободный доступ кислорода.
Применение в медицине
Гипохлорит натрия применение себе находит и в медицинских целях. Ведь его дезинфицирующие, бактерицидные и очищающие свойства не могли остаться незамеченными в этой области. Как конкретно его используют?
- Для обработки гнойных ран, открытых мест повреждений.
- Для дезинфекции инструментов, обработки рабочих поверхностей и санитарных зон.
- Для лечения целого ряда инфекционных заболеваний, вызванных вирусами, бактериями или грибками (ВИЧ, герпес, гепатит А и Б, хламидиоз и прочие).
- В хирургии для обработки дренажных ран, внутренних полостей при гнойных поражениях.
- В акушерстве и гинекологии.
- В оториноларингологии и дерматологии, применяются даже растворы для инъекций или закапывания внутрь слухового прохода.
Применение этого средства позволяет избегать высокой смертности при распространении инфекций в малоразвитых странах.
Жавелевая вода в химических синтезах
На основе рассматриваемого вещества создаются различные чистящие и моющие средства, препараты для обработки санузлов и прочистки труб. Также с помощью хлорноватистого натрия синтезируются различные отбеливатели для тканей, которые способны удалять самые сложные пятна (например, от кофе, вина, травы и прочее).
На основе лабарраковой воды создаются средства для разложения бытовых и промышленных отходов. Причем на такие вещества, которые будут максимально безопасны для окружающей среды.

Во многих реакциях используются сильные окислительные свойства соединения, так получают многие другие важные вещества в химии.
Использование в животноводстве и растениеводстве
В данных отраслях народного хозяйства также используется гипохлорит натрия. Так, например, в животноводстве он нужен для уборки помещений, в которых живут животные. Это позволяет избавить их от нечистот, продезинфицировать и уничтожить болезнетворные микроорганизмы. Тем самым сокращается заболеваемость скота.
В растениеводстве натрий гипохлорит также позволяет избежать заражения грибками и бактериями. При предпосевной обработке семян раствором жавелевой воды рост заболеваний среди сельскохозяйственных культур резко сокращается. Иногда обрабатываются и сами растения с целью также бактерицидного действия.
Особенности и условия хранения
Так как вещество особенное, то и уход за ним особенный. Существует целый список, который описывает, как правильно хранить и использовать гипохлорит натрия. ГОСТ 11086-76 дает технические характеристики и рассказывает обо всех особенностях, касающихся хранения и транспортировки, а также использования и уничтожения отходов после применения для жавелевой воды.
Там же описаны все марки товара, подробные характеристики. Поэтому перед применением или покупкой необходимо с данным документом тщательно ознакомиться. В целом же, хранение гипохлорита натрия должно осуществляться в темных помещениях, специальных устойчивых к окислению и коррозии емкостях. Его нельзя нагревать, так как может произойти взрыв. Перевозить можно любым способом, но с соблюдением правил техники безопасности.
Гипохлорит натрия: инструкция по применению
Если говорить о применении рассматриваемого вещества внутрь, то здесь необходимы строгие медицинские рекомендации. Ведь входящий в состав соединения хлор может оказать пагубное воздействие на организм. Можно получить химический ожог, отравление и т. д. Это еще не все, к чему может привести неконтролируемый прием такого вещества, как гипохлорит натрия. Инструкция по применению препаратов на его основе должна быть тщательно изучена и согласована с лечащим врачом, применение его самостоятельно в лечебных целях запрещено!
Инструкция по применению растворов гипохлорита натрия и кальция для целей дезинфекции
(утв. Главным санитарно-эпидемиологическим управлением
Министерства здравоохранения СССР 25 ноября 1971 г. № 942а-71)
I. Общие положения
Гипохлориты натрия и кальция являются солями хлорноватистой кислоты. Их растворы получают заводским способом - поглощением хлора раствором едкого натра (гипохлорит натрия) или известковым молоком (гипохлорит кальция).
В некоторых отраслях промышленности растворы гипохлоритов являются отходами производств.
В соответствии с техническими условиями растворы гипохлорита натрия выпускают трех марок А, Б и В, отличающихся друг от друга по содержанию активного хлора, остаточной щелочности и внешнему виду.
Марки А и Б - прозрачные зеленовато-желтые жидкости (допускается взвесь) с содержанием активного хлора 17 %.
Марка В - жидкость от желтого до коричневого цвета, выпускается I и II сортов, содержащих 12 и 9,5 % активного хлора соответственно.
Раствор гипохлорита кальция окрашен, содержит примесь взвешенных частиц, выпускается промышленностью в виде I и II сорта с содержанием активного хлора 10 и 8 % соответственно.
1 раствора гипохлорита кальция соответствует 0,23 - 0,28 т хлорной извести, содержащей 35 % активного хлора. На заводах-изготовителях растворы гипохлоритов заливают в стальные гуммированные цистерны или контейнеры, а также в полиэтиленовые канистры или бочки емкостью 20 - 60 л. Растворы гипохлорита натрия и кальция разлагаются при хранении, в связи с чем их хранят в закрытом, сухом, прохладном, хорошо проветриваемом нежилом помещении.
Ввиду слабой стойкости растворов гипохлоритов и возможных нарушений правил хранения и приготовления рабочих растворов необходимо проводить проверку препаратов и приготовленных рабочих растворов йодометрическим методом на содержание активного хлора. Гипохлориты обладают бактерицидным и спорицидным действием.
II. Применение растворов гипохлорита натрия и кальция
Растворы гипохлорита натрия и кальция используют взамен хлорной извести и ДТСГК при текущей, заключительной и профилактической дезинфекции для обеззараживания различных предметов и выделений в очагах инфекционных заболеваний, а также для обеззараживания специальных объектов. Обеззараживание проводят орошением, протиранием мытьем, замачиванием объектов, не портящихся при таком способе обработки.
Белье и прочие ткани, а также металлические предметы, если они не защищены от коррозии, и окрашенные вещи обеззараживанию растворами гипохлоритов не подлежат.
При инфекциях, вызванных вегетативными формами микроорганизмов, растворы гипохлорита натрия и кальция применяют по следующим режимам.
1. Обеззараживание помещений (пол, стены), простой деревянной мебели, надворных установок проводят орошением растворами в концентрации 1 % по активному хлору из расчета 300 - 500 мл/м 2 при экспозиций 1 час. По окончании дезинфекции помещения обязательно проветривают.
2. Для обеззараживания малоценных мягких вещей, а также ветоши, уборочного материала применяют растворы, содержащие 1 % активного хлора, из расчета 4 - 5 л на 1 кг сухого веса вещей и выдерживают в течение 1 часа.
3. Посуду обеззараживают при полном погружении в 0,25 % - 1 % по активному хлору раствор, в зависимости от наличия остатков пищи, на 1 час из расчета 1,5 л раствора на 1 комплект. По окончании дезинфекции посуду тщательно промывают водой.
4. Ванны, унитазы, раковины и другое санитарно-техническое оборудование двукратно обильно орошают растворами 1 % концентрации.
5. Жидкие выделения, остатки пищи и др. отбросы заливают неразведенными растворами гипохлоритов в соотношении 1:1.
Для обеззараживания ночной посуды после удаления обеззараженного содержимого используют 0,25 % по активному хлору растворы гипохлоритов, после чего посуду промывают водой.
6. Обеззараживание верхних слоев почвы, асфальта и др. объектов вне помещения производят растворами гипохлоритов в концентрации 1 % по активному хлору из расчета 1,5 л/м 2 .
III. Меры личной профилактики
При выполнении дезинфекционных работ растворами гипохлорита натрия или кальция каждый работающий обязан строго соблюдать меры личной безопасности, для чего следует пользоваться индивидуальными средствами защиты (респиратор РУ-60 с патроном марки А; защитные очки, резиновые перчатки; защитные передники).
При попадании растворов гипохлорита натрия и кальция на кожу и слизистую глаз необходимо быстро и обильно промыть струей чистой воды.
IV. Приготовление рабочих растворов гипохлорита натрия и кальция
|
Количество (мл) раствора гипохлоритов, необходимое для приготовления 10 л рабочего раствора |
||
|
0,25 % по активному хлору |
1 % по активному хлору |
|
|
1000 |
||
|
1110 |
||
|
1250 |
||
|
2000 |
||
Отходы промышленности, содержащие гипохлориты с нестандартным количеством активного хлора, могут быть также использованы для целей дезинфекции в порядке, предусмотренном данной инструкцией.
Временную инструкцию по применению гипохлорита натрия для целей дезинфекции, утвержденную Министерством здравоохранения 12 августа 1970 г., считать утратившей силу.
Гипохлорит натрия (ГПХН) считается химическим соединением, применяющимся для дезинфекции и обеззараживания различных материалов, поверхностей, жидкостей и т.д. В чистом виде это кристаллическое вещество, которое не имеет характерного цвета, при этом оно очень неустойчивое. Химическая формула гипохлорита натрия NaClO.
Если рассматривать процентное соотношение основных химических элементов в этом веществе, то в гипохлорите натрия хлора примерно 47%, натрия - 30%, а кислорода - 22%. Это вещество способно быстро растворяться в водной среде, температура кипения безводного ГПХН примерно такая же, как и у воды +101°C. Молярная масса составляет 74,44 г/моль.
Главным государственным документом, который регламентирует качество этого химического вещества, считается ГОСТ 11086 «Гипохлорит натрия. Технические условия».
Способ получения и виды ГПХН
Чтобы получить гипохлорит натрия необходимо провести процесс хлорирования едкого натра с помощью молекулярного хлора. Также это вещество можно получить с помощью электролиза раствора поваренной соли. Производство гипохлорита натрия - это сложный химический процесс, который основан на изготовлении разных растворов ГПХН. Каждый раствор отличается по концентрации, поэтому существует несколько марок гипохлорита натрия.
Согласно межгосударственному ГОСТу гипохлорит натрия может выпускаться только двух марок: А и Б. Но стоит отметить, что для этого вещества были разработаны и ТУ, которые регламентируют качественные характеристики и для других марок. Согласно этим документам гипохлорит натрия может производиться 5 марок: А, Б, В, Г, Э.
Каждая из этих марок имеет свою специализацию:
- . марка А создана для дезинфекции питьевой воды, а также воды для бассейнов,
- . марка Б разработана для отбеливания и очищения тканей,
- . марка В и Г по ТУ специализируется на очистке воды в рыбных хозяйствах,
- . марка А и Э гипохлорита натрия по ТУ применяются для дезинфекции питьевых водных ресурсов, оборудования в больницах и санаториях, обеззараживания сточных вод, вод рыбных хозяйств. Эти две марки считаются одними из самых универсальных.
Всемирное применение гипохлорита натрия обусловлено его химической способностью к нейтрализации целого ряда вредных микроорганизмов. Его бактерицидные свойства направлены на уничтожение целого ряда опасных грибков и бактерий. Самыми яркими представителями этого класса организмов, с которыми активно ведет борьбу гипохлорит натрия, есть:
- . грибок Candida albicans,
- . патогенные энтерококки,
- . некоторые виды анаэробных бактерий.
Раствор гипохлорита натрия способен в течение 15-30 секунд убить все вышеперечисленные микроорганизмы. Кроме того, чем выше концентрация ГПХН, тем быстрее происходит процесс дезинфекции. Но уровень концентрации должен четко контролироваться, так как зачастую обрабатываемая вода попадает непосредственно к потребителю через очистные системы водоснабжения.

Принцип действия гипохлорита натрия достаточно простой, та как это вещество имеет высокие биоцидные свойства. Когда гипохлорит натрия попадает в воду, он начинает активно разлагаться, образовывая при этом активные частицы в виде радикалов и кислорода.
Радикалы ГПХН можно считаться основным «оружием», направленным против вредных микроорганизмов. Активные частицы ГПХН начинают разрушать внешнюю оболочку или биопленку микроорганизма, таким образом, это приводит к окончательной гибели различных патогенных грибков, вирусов и бактерий.
Из-за такого мощного обеззараживающего эффекта, это вещество должно проходить строгий контроль качества. Тем более, когда его применяют для очистки питьевой воды. После обработки гипохлоритом натрия воду проверят на:
- . наличие тяжелых металлов,
- . цветность,
- . уровень стабильности,
- . концентрацию щелочи,
- . концентрацию хлора.
Сферы применения
Химический состав гипохлорита натрия направлен на обеззараживание и дезинфекцию воды. Поэтому это вещество занимает важное место во многих сферах человеческой жизни. Мировые исследования показывают, что ГПХН для дезинфекции применяют в 91% случаев, остальные 9% включают гипохлорит калия или лития. Но чтобы это вещество дало результат и пользу в быту, необходимо внимательно следить за концентрацией раствора. Для этого нужно внимательно читать инструкцию к гипохлориту натрия.
Основными тремя сфера использования этого химического вещества считают:
- . медицину,
- . легкую и тяжелую промышленность.
- . бытовое применение.
В инструкции по применению гипохлорита натрия в быту указано, что это вещество можно применять для дезинфекции и обеззараживания поверхностей, тканей, сантехнических засорений и т.д.

В промышленной отрасли гипохлорит натрия марки А и Э нашел свое применение в сфере отбеливания ткани и древесных материалов. Эти две марки ГПХН способствуют очистке коммунальных и сточных вод.
Медицинские препараты и дезинфицирующие средства с гипохлоритом натрия играют немаловажную роль.. С помощью этого вещества производят обеззараживание и чистку ран от ожогов, послеоперационных швов и т.д. Это вещество помогло избавиться от напасти холеры, брюшного тифа в странах Латинской Америки. Также его вводят внутривенно. В медицине ГПХН используют в:
- . стоматологии,
- . гинекологии,
- . хирургии,
- . дерматологии.
Цена на гипохлорит натрия в РФ за 1 литр в среднем составляет 60-70 рублей. Его упаковывают в полиэтиленовые канистры и бочки.
Последние материалы сайта
Успенский Э.Н.
Страны юго западной азии
Азия - крупнейшая из частей света, ее площадь 43,4 млн. км.кв (29,2% площади земной суши). Численность населения континента составляет около 4,4 млрд человек (почти 59,5% населения мира). На современной политической карте Азии расположено 47 независимых г
Горький Максим
Правописание чередующихся гласных в корне слова
Имеются корни, в которых написание букв на месте безударных гласных не соответствует общему правилу, а подчиняется традиции. К ним относятся следующие корни с чередующимися гласными. 1. Корни с буквами а и о . гар - гор . На месте безударного гласного пи
Автор неизвестен

День памяти и маковый цветок в великобритании
Каждый год 11 ноября в Великобритании отмечается День Памяти, дата называется по-английски Remembrance Day . Она посвящена всем погибшим в войнах – в Первой и Второй Мировых и в других национальных войнах. 11 ноября был выбран не случайно, это день оконч
Успенский Э.Н.
Основные источники по истории Древних Германцев
Этимология этнонима германцы «Слово Германия - новое и недавно вошедшее в обиход, ибо те, кто первыми переправились через Рейн и прогнали галлов , ныне известные под именем тунгров, тогда прозывались германцами. Таким образом, наименование племени пост
Толстой А.Н.

Игорь васильевич северянин Сергей северянин
1887 , 4 (16) мая – родился в Петербурге в семье отставного штабс-капитана. Первые 9 лет провел в Петербурге. 1903 – закончив 4 класса Череповецкого реального училища, весной совершил с отцом поездку в Порт Дальний (Далянь, Китай), где прожил полгода.19
Андерсен Х.К.
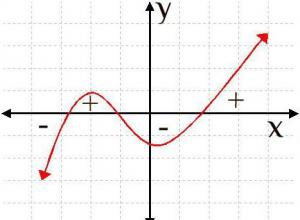
Как найти точки минимума и максимума функции: особенности, способы и примеры
Функция и исследование ее особенностей занимает одно из ключевых глав в современной математике. Главная составляющая любой функции - это графики, изображающие не только ее свойства, но также и параметры производной данной функции. Давайте разберемся в это