«основы химической термодинамики, химической кинетики и равновесия» Основы химической термодинамики - Документ. Химическая кинетика и термодинамика любой процесс протекает Коллоквиум 1 кинетика и термодинамика
1 . Что изучает химическая термодинамика:
1) скорости протекания химических превращений и механизмы этих превращений;
2) энергетические характеристики физических и химических процессов и способность химических систем выполнять полезную работу;
3) условия смещения химического равновесия;
4) влияние катализаторов на скорость биохимических процессов.
2. Открытой системой называют такую систему, которая:
2) обменивается с окружающей средой и веществом, и энергией;
3. Закрытой системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом ;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
4. Изолированной системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией ;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
5. К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле, помещен ной в термостат?
1) изолированной;
2) открытой;
3) закрытой;
4) стационарной.
6. К какому типу термодинамических систем принадле жит раствор, находящийся в запаянной ампуле?
1) изолированной;
2) открытой;
3) закрытой;
4) стационарной.
7. К какому типу термодинамических систем принадле жит живая клетка?
1) открытой ;
2) закрытой;
3) изолированной;
4) равновесной.
8 . Какие параметры термодинамической системы назы-Iвают экстенсивными?
1) величина которых не зависит от числа частиц в системе;
2) величина которых зависит от числа частиц в системе ;
3) величина которых зависит от агрегатного состояния системы;
9. Какие параметры термодинамической системы называют интенсивными?
!) величина которых не зависит от числа частиц в системе ;
2) величина которых зависит от числа частиц в системе;
3) величина которых зависит от агрегатного состояния;
4) величина которых зависит от времени.
10 . Функциями состояния термодинамической системы называют такие величины, которые:
1) зависят только от начального и конечного состояния системы ;
2) зависят от пути процесса;
3) зависят только от начального состояния системы;
4) зависят только от конечного состояния системы.
11 . Какие величины являются функциями состояния системы: а) внутренняя энергия; б) работа; в) теплота; г) энтальпия; д) энтропия.
1) а, г, д;
3) все величины;
4) а, б, в, г.
12 . Какие из следующих свойств являются интенсивными: а) плотность; б) давление; в) масса; г) температура; д) энтальпия; е) объем?
1) а, б, г;
3) б, в, г, е;
13. Какие из следующих свойств являются экстенсивными: а) плотность; б) давление; в) масса; г) температура; д) энтальпия; е) объем?
1) в, д, е;
3) б, в, г, е;
14 . Какие формы обмена энергией между системой и окружающей средой рассматривает термодинамика: а) теплота; б) работа; в) химическая; г) электрическая; д) механическая; е) ядерная и солнечная?
1)а,б;
2) в, г,д, е;
3) а, в, г, д, е;
4) а, в, г, д.
15. Процессы, протекающие при постоянной температуре, называются:
1) изобарическими;
2) изотермическими ;
3) изохорическими;
4) адиабатическими.
16 . Процессы, протекающие при постоянном объеме, называются:
1) изобарическими;
2) изотермическими;
3) изохорическими;
4) адиабатическими.
17 . Процессы, протекающие при постоянном давлении, называются:
1) изобарическими ;
2) изотермическими;
3) изохорическими;
4) адиабатическими.
18 . Внутренняя энергия системы - это:1) весь запас энергии системы, кроме потенциальной энергии ее положения и кинетической энергии системы в целом;
2) весь запас энергии системы;
3) весь запас энергии системы, кроме потенциальной энергии ее положения;
4) величина, характеризующая меру неупорядоченности расположения частиц системы.
19 . Какой закон отражает связь между работой, теплотой и внутренней энергией системы?
1) второй закон термодинамики;
2) закон Гесса;
3) первый закон термодинамики;
4) закон Вант-Гоффа.
20 . Первый закон термодинамики отражает связь между:
1) работой, теплотой и внутренней энергией;
2) свободной энергией Гиббса, энтальпией и энтропией системы;
3) работой и теплотой системы;
4) работой и внутренней энергией.
21 . Какое уравнение является математическим выражением первого закона термодинамики для изолированных систем?
l)AU=0 2)AU=Q-p-AV 3)AG = AH-TAS
22 . Какое уравнение является математическим выражением первого закона термодинамики для закрытых систем?
2)AU=Q-p-AV ;
3) AG = AH - T*AS;
23 . Постоянной или переменной величиной является внутренняя энергия изолированной системы?
1) постоянной;
2) переменной.
24 . В изолированной системе протекает реакция сгорания водорода с образованием жидкой воды. Изменяется ли внутренняя энергия и энтальпия системы?
1) внутренняя энергия не изменится, энтальпия изменится;
2) внутренняя энергия изменится, энтальпия не изменится ;
3) внутренняя энергия не изменится, энтальпия не изменится;
4) внутренняя энергия изменится, энтальпия изменится.
25 . При каких условиях изменение внутренней энергии равно теплоте, получаемой системой из окружающей среды?
1) при постоянном объеме ;
3) при постоянном давлении;
4) ни при каких.
26 . Тепловой эффект реакции, протекающей при постоянном объеме, называется изменением:
1) энтальпии;
2) внутренней энергии;
3) энтропии;
4) свободной энергии Гиббса.
27 . Энтальпия реакции - это:
1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно-изотер-мических условиях ;
4) величина, характеризующая меру неупорядоченности расположения и движения частиц системы.
28. Химические процессы, при протекании которых происходит уменьшение энтальпии системы и во внешнюю среду выделяется теплота, называются:
1) эндотермическимий;
2) экзотермическими;
3) экзэргоническими;
4) эндэргоническими.
29 . При каких условиях изменение энтальпии равно теплоте, получаемой системой из окружающей среды?
1) при постоянном объеме;
2) при постоянной температуре;
3) при постоянном давлении ;
4) ни при каких.
30 . Тепловой эффект реакции, протекающей при посто-янном давлении, называется изменением:
1) внутренней энергии;
2) ни одно из предыдущих определений неверно;
3) энтальпии;
4) энтропии.
31. Какие процессы называют эндотермическими?
1) для которых АН отрицательно;
3) для которых АН положительно ;
32 . Какие процессы называют экзотермическими?
1) для которых АН отрицательно ;
2) для которых AGотрицательно;
3) для которых АН положительно;
4) для которых AGположительно.
33 . Укажите формулировку закона Гесса:
1) тепловой эффект реакции зависит только от начального и конечного состояния системы и не зависит от пути реакции ;
2) теплота, поглощаемая системой при постоянном объеме, равна изменению внутренней энергии системы;
3) теплота, поглощаемая системой при постоянном давлении, равна изменению энтальпии системы;
4) тепловой эффект реакции не зависит от начального и конечного состояния системы, а зависит от пути реакции.
34. Какой закон лежит в основе расчетов калорийности продуктов питания?
1) Вант-Гоффа;
2) Гесса;
3) Сеченова;
35. При окислении каких веществ в условиях организма выделяется большее количество энергии?
1) белков;
2) жиров ;
3) углеводов;
4) углеводов и белков.
36 . Самопроизвольным называется процесс, который:
1) осуществляется без помощи катализатора;
2) сопровождается выделением теплоты;
3) осуществляется без затраты энергии извне ;
4) протекает быстро.
37 . Энтропия реакции - это:
1) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изобарно-изотер-мических условиях;
2) количество теплоты, которое выделяется или поглощается в ходе химической реакции при изохорно-изотер-мических условиях;
3) величина, характеризующая возможность самопроизвольного протекания процесса;
4) величина, характеризующая меру неупорядоченности расположения и движения частиц системы.
38 . Какой функцией состояния характеризуется тенденция системы к достижению вероятного состояния, которому соответствует максимальная беспорядочность распределения частиц?
1) энтальпией;
2) энтропией ;
3) энергией Гиббса;
4) внутренней энергией.
39 . В каком соотношении находятся энтропии трех агрегатных состояний одного вещества: газа, жидкости, твердого тела:
I ) S (г) > S (ж) > S (тв); 2)S(тв)>S(ж)>S(г); 3)S(ж)>S(г)>S(TB); 4) агрегатное состояние не влияет на значение энтропии.
40 . В каком из следующих процессов должно наблюдаться наибольшее положительное изменение энтропии:
1) СН3ОН (тв) --> СН,ОН (г);
2) СH3OH(тв) --> СН 3 ОН (ж);
3) СН,ОН (г) -> CH3OH(тв);
4) СН,ОН (ж) -> СН3ОН (тв).
41 . Выберите правильное утверждение: энтропия системы увеличивается при:
1) повышении давления;
2) переходе от жидкого к твердому агрегатному состоянию
3) повышении температуры;
4) переходе от газообразного к жидкому состоянию.
42. Какую термодинамическую функцию можно использовать, чтобы предсказать возможность самопроизвольного протекания реакции в изолированной системе?
1) энтальпию;
2) внутреннюю энергию;
3) энтропию;
4) потенциальную энергию системы.
43 . Какое уравнение является математическим выражением 2-го закона термодинамики для изолированных систем?
2)AS>Q\T
44 . Если система обратимым образом получает количество теплотыQпри температуре Т, то обT;
2) возрастает на величину Q / T ;
3) возрастает на величину, большую Q/T;
4) возрастает на величину, меньшую Q/T.
45 . В изолированной системе самопроизвольно протекает химическая реакция с образованием некоторого количества продукта. Как изменяется энтропия такой системы?
1) увеличивается
2) уменьшается
3) не изменяется
4) достигает минимального значения
46 . Укажите, в каких процессах и при каких условиях изменение энтропии может быть равно работе процесса?
1) в изобарных, при постоянных Р и Т;
2) в изохорных, при постоянных Vи Т;
З) изменение энтропии никогда не равно работе;
4) в изотермических, при постоянных Р и 47 . Как изменится связанная энергия системыTSпри нагревании и при ее конденсации?
Страница 1
ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ И ХИМИЧЕСКОЙ КИНЕТИКИ
|
Параметр |
Обозначение, единица |
Смысловое значение |
|
Внутренняя энергия |
U, кДж/моль |
Полная энергия системы, равная сумме кинетической, потенциальной и других видов энергии всех частиц этой системы. Это функция состояния, приращение которой равно теплоте, полученной системой в изохорном процессе. |
|
Работа |
А, кДж/моль |
Энергетическая мера направленных форм движения частиц в процессе взаимодействия системы с окружающей средой. |
|
Теплота |
Q, кДж/моль |
Энергетическая мера хаотических форм движения частиц в процессе взаимодействия системы с окружающей средой. |
|
Первый закон термодинамики |
Q=∆U+A |
Теплота, подведенная к закрытой системе, расходуется на увеличение внутренней энергии системы и на совершение системой работы против внешних сил окружающей среды. |
|
Энтропия |
S, Дж.(моль∙К) ∆S=Q/T, ∆S° р - ции =∑v 1 S°(прод.р-ции)-∑v 1 (исх.в-в) |
Функция состояния, характеризующая меру неупорядоченности системы, т.е. неоднородности расположения и движения её частиц, приращение которой равно теплоте, подведенной к системе в обратимом изотермическом процессе, деленной на абсолютную температуру, при которой осуществляется процесс. |
|
Энтальпия |
H, кДж/моль ∆H=∆U+p∆V |
Функция состояния, характеризующая энергетическое состояние системы в изобарных условиях. |
|
Энтальпия реакции |
∆H р-ции, кДж/моль |
Количество теплоты, которое выделяется или поглощается при проведении химических реакций в изобарных условиях. |
|
Стандартное состояние |
- |
Наиболее устойчивая форма при заданной температуре (обычно 298 К) и давлении 1атм. |
|
Стандартные условия |
с.у. |
Давление: 101 325 Па=1атм=760 мм рт.ст. Температура: 25⁰С≈298К. n(X)=1 моль. |
|
Стандартная энтальпия образования простых веществ |
|
При с.у. принимается равной нулю для простых веществ в их наиболее термодинамически устойчивом агрегатном и аллотропном состояниях. |
|
Стандартная энтальпия образования сложных веществ |
∆H° обр298 (вещество, агрегатное состояние), кДж/моль |
Энтальпия реакции образования 1 моль этого вещества из простых веществ в с.у. |
|
Стандартная энтальпия сгорания |
∆H° сгор (X), кДж/моль |
Энтальпия сгорания (окисления) 1 моль вещества до высших оксидов в среде кислорода при с.у. |
|
Энтальпия растворения |
∆H° р-ции,кДж/моль Где - теплоемкость раствора |
Тепловой эффект растворения твердого вещества в изобарных условиях. |
|
Энергия Гиббса |
G, кДж/моль ∆G°=∆Н-Т∆S, ∆G° р-ции =∑v 1 ∆G° 1 (прод.р-ции)-∑ v 1 ∆G° 1 (исх.в-в) |
Свободная энергия, обобщенная термодинамическая функция состояния системы, учитывающая энергетику и неупорядоченность системы в изобарных условиях. |
|
Константа равновесия химической реакции для равновесия |
К равн, (моль/л) ∆ v , где ∆v зависит от значений стехиометрических коэффициентов веществ. Для реакции aA+bB=cC+dD |
Равна отношению произведения равновесных концентрация продуктов реакции к произведению равновесных концентраций реагентов в степенях, равных стехиометрическим коэффициентам. |
|
Уравнение изотермы Вант-Гоффа |
Для обратимой реакции aA+bB=cC+dD , ∆G° р-ции =-RTlnK равн,
|
Позволяет рассчитать энергию Гиббса при заданных значениях концентраций реагентов и продуктов реакции. |
|
Закон действующих масс для кинетики |
V=kc(A) a c(B) b |
Скорость реакции пропорциональна произведению концентраций реагирующих веществ в степенях, которые называются порядками реакции по соответствующим веществам. |
|
Порядок реакции по веществу |
n i |
Показатель степени, в которой входит концентрация реагента в уравнение для скорости химической реакции. Порядок может быть любой величиной: целой, дробной, положительной, нулем, отрицательной и даже переменной, зависящей от глубины протекания реакции. |
|
Общий порядок реакции |
n=n λ +n β +… |
Сумма порядков реакции по всем реагентам. |
|
Средняя скорость реакции по веществу |
|
Усредненная скорость по веществу за данный промежуток времени |
|
Истинная скорость реакции |
|
Характеризует скорость реакции в данный момент времени (∆τ→0); v 1 – стехиометрический коэффициент вещества в реакции. |
|
Истинная скорость реакции по веществу |
|
Характеризует скорость по веществу в данный момент времени (∆τ→0). |
|
Константа скорости реакции |
k, c -1 – для реакций 1-го порядка; л/(моль∙с) – для реакций 2-го порядка |
Индивидуальная характеристика реакции, численно равна скорости реакции при концентрациях реагентов, равных 1 моль/л. |
|
Энергия активации |
Е а, кДж/моль |
Минимальная избыточная энергия взаимодействующих частиц, достаточная для того, чтобы эти частицы вступили в химическую реакцию. |
|
Период полупревращения |
Τ1/2, с, мин, ч, сут |
Время, за которое концентрация реагирующего вещества уменьшается вдвое. |
|
Период полураспада |
Τ1/2, с, мин, ч, сут |
Время, за которое количество радиоактивного уменьшается в 2 раза. |
|
Кинетическое уравнение для реакций 1-горядка (интегральная форма) |
c=c 0 е - kt
|
Уравнение линейно относительно переменных ln с и t; k- константа скорости реакции 1-го порядка; с 0 -концентрация исходного вещества в начальный момент времени; с- текущая концентрация исходного вещества в момент времени t; t – время, прошедшее от начала реакции. |
|
Правило Вант-Гоффа |
где - температурный коэффициент скорости реакции; |
Транскрипт
1 4. Химический процесс. Почему и как идут химические реакции? Термодинамика и кинетика В первой половине XIX века возникла потребность в совершенствовании тепловых машин, производящих механическую работу за счет химических реакций горения. Такими тепловыми машинами в то время было огнестрельное оружие и паровые двигатели. В результате в середине XIX века было создана термодинамика или механическая теория тепла. Термин thermodynamics «термодинамика» предложил в 1851 г. английский ученый Уильям Томсон (лорд Кельвин с 1892) (). Немецкий исследователь Рудольф Юлиус Эмануэль Клаузиус () называл новую науку Mechanische Warmetheorie «механическая теория тепла». Современное определение: Химическая термодинамика наука о зависимости направления и пределов превращений веществ от условий, в которых эти вещества находятся В отличие от других разделов физической химии (строение вещества и химическая кинетика), химическую термодинамику можно применять, ничего не зная о строении вещества. Такое описание требует значительно меньше исходных данных. Конкретный объект термодинамического исследования называют термодинамической системой или просто системой, выделенной из окружающего мира реально существующими или воображаемыми поверхностями. Системой может быть газ в сосуде, раствор реагентов в колбе, кристалл вещества или даже мысленно выделенная часть этих объектов. По уровням взаимодействия с окружающей средой термодинамические системы принято делить на: открытые обмениваются с окружающей средой веществом и энергией (например, живые объекты); закрытые обмениваются только энергией (например, реакция в закрытой колбе или колбе с обратным холодильником), наиболее частый объект химической термодинамики; изолированные не обмениваются ни веществом, ни энергией и сохраняют постоянный объем (приближение реакция в термостате). Строгое термодинамическое рассмотрение возможно только для изолированных систем, которые не существуют в реальном мире. В то же время термодинамика может достаточно точно описывать закрытые и даже открытые системы. Для того, чтобы систему можно было описать термодинамически, она должна состоять из большого числа частиц, сопоставимого с числом Авогадро и таким образом соответствовать законам статистики. Свойства системы разделяют на экстенсивные (суммирующиеся) например, общий объем, масса, и интенсивные (выравнивающиеся) давление, температура, концентрация и т.п. Наиболее важны для расчетов функции состояния такие термодинамические функции, значения которых зависят только от состояния системы и не зависят от пути перехода между состояниями. Процесс в термодинамике это не развитие события во времени, а последовательность равновесных состояний системы, ведущих от начального набора термодинамических переменных к конечному. Термодинамика позволяет полностью решить поставленную задачу, если исследуемый процесс в целом описывается совокупностью равновесных стадий. 11

2 В термодинамических расчетах используют численные данные (табличные) о термодинамических свойствах веществ. Даже небольшие наборы таких данных позволяют рассчитывать множество различных процессов. Для расчета равновесного состава системы не требуется записывать уравнения возможных химических реакций, достаточно учесть все вещества, которые могут в принципе составлять равновесную смесь. Таким образом, химическая термодинамика не дает чисто расчетного (неэмпирического) ответа на вопрос почему? и тем более как? ; она решает задачи по принципу если..., то.... Для тепловых расчетов наиболее важен первый закон термодинамики одна из форм закона сохранения энергии. Его формулировки: Энергия не создается и не уничтожается. Вечный двигатель (perpetuum mobile) первого рода невозможен. В любой изолированной системе общее количество энергии постоянно. Впервые обнаружил связь между химическими реакциями и механической энергией Ю.Р.Майер (1842) [ 1 ], механический эквивалент теплоты измерил Дж.П.Джоуль (). Для термохимических расчетов закон сохранения энергии используется в формулировке Г.И.Гесса: «Когда образуется какое-либо химическое соединение, то при этом всегда выделяется одно и то же количество тепла независимо от того, происходит ли образование этого соединения непосредственно или же косвенным путем и в несколько приемов». Этот закон «постоянства сумм тепла» Гесс огласил в докладе на конференции Российской Академии наук 27 марта 1840 г. [ 2 ] Современная формулировка: «Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса» Энтальпия В общем случае работа, совершаемая химической реакцией при постоянном давлении, состоит из изменения внутренней энергии и работы расширения образующегося газа: ΔQ p = ΔU + pδv Для большинства химических реакций, проводимых в открытых сосудах, удобно использовать функцию состояния, приращение которой равно теплоте, полученной системой в изобарном (т.е. идущем при постоянном давлении) процессе. Эта функция называется энтальпи я (от греч. энтальпо нагреваю) [ 3 ]: ΔQ p = ΔH = ΔU + pδv Другое определение: разность энтальпий в двух состояниях системы равна тепловому эффекту изобарного процесса. 1. В 1840 г. немецкий врач Юлиус Роберт Майер () работал судовым врачом на рейсе из Европы на Яву. Он обратил внимание, что венозная кровь в тропиках светлее, чем в Германии, и сделал вывод, что в тропиках для поддержания той же температуры тела нужно меньше кислорода. Следовательно, теплота и работа могут взаимно превращаться. В 1842 г. Майер теоретически оценил механический эквивалент теплоты в 365 кгм (соврем. 427 кгм) 2 Трифонов Д.Н. "Характер прямой и благородный" (К 200-летию Германа Ивановича Гесса) 3. Название энтальпия предложил нидерландский физик Гейке Камерлинг-Оннес (). 12

3 Именно энтальпия оказалась удобной для описания работы как паровых машин, так и огнестрельного оружия, поскольку в обоих случаях используется расширение горячих газов или водяного пара. Существуют обширные таблицы, содержащие данные по стандартным энтальпиям образования веществ ΔH o 298. Индексы означают, что для химических соединений приведены энтальпии образования 1 моль их из простых веществ, взятых в наиболее устойчивой модификации при 1 атм (1, Па или 760 мм.рт.ст) и 298,15 К (25 о С). Если речь идет об ионах в растворе, то стандартной является концентрация 1 моль/л. Для самих простых веществ принята энтальпия образования, равная 0 (кроме белого фосфора не самой устойчивой, а самой воспроизводимой формы фосфора). Знак энтальпии определяется с точки зрения самой системы: при выделении теплоты изменение энтальпии отрицательно, при поглощении теплоты изменение энтальпии положительно. Пример термохимического расчета чрезвычайно сложной реакции: Энтальпию образования глюкозы из углекислого газа и воды нельзя определить прямым экспериментом, получить глюкозу из простых веществ невозможно. Но мы можем вычислить энтальпии этих процессов. 6 C + 6 H O 2 = C 6 H 12 O 6 (ΔH х -?) Такая реакция невозможна 6 CO H 2 O = C 6 H 12 O O 2 (ΔH у -?) реакция идет в зеленых листьях, но вместе с другими процессами Найдем ΔH х алгебраическим путем. Пользуясь законом Гесса, достаточно скомбинировать три уравнения сжигания: 1) C + O 2 = CO 2 ΔH 1 = -394 кдж 2) H 2 + 1/2 O 2 = H 2 O (пар) ΔH 2 = -242 кдж 3) C 6 H 12 O O 2 = 6 CO H 2 O ΔH 3 = кдж Складываем уравнения «в столбик», умножая 1-е и 2-е на 6 и «разворачивая» третье, тогда: 1) 6 C + 6 O 2 = 6 CO 2 ΔH 1 = 6(-394) кдж 2) 6 H O 2 = 6 H 2 O (пар) ΔH 2 = 6(-242) кдж 3) 6 CO H 2 O = C 6 H 12 O O 2 ΔH 3 = кдж При расчете энтальпии учитываем, что при «развороте» уравнения 3 она поменяла знак: ΔH х = 6 ΔH ΔH 2 - ΔH 3 = 6(-394) + 6(-242) -(-2816) = кдж/моль Очевидно, что ΔH у соответствует процессу, обратному фотосинтезу, т.е. горению глюкозы. Тогда ΔH у = -ΔH 3 = кдж При решении не использованы никакие данные по строению глюкозы; не рассматривался также механизм ее горения Задача Определите энтальпию получения 1 моль озона О 3 из кислорода, если известно, что при сгорании 1 моль кислорода в избытке водорода выделяется 484 кдж, а при сгорании 1 моль озона в избытке водорода выделяется 870 кдж Второй закон термодинамики. Энтропия Второй закон термодинамики по У.Томсону (1851): в природе невозможен процесс, единственным результатом которого была бы механическая работа, совершенная за счет охлаждения теплового резервуара. 13

4 Формулировка Р.Клаузиуса (1850): теплота сама по себе не может перейти от более холодного тела к более теплому или: невозможно сконструировать машину, которая, действуя посредством кругового процесса, будет только переносить теплоту с более холодного тела на более теплое. Самая ранняя формулировка второго закона термодинамики появилась раньше первого закона, на основании работы, выполненной во Франции С.Карно (1824) и ее математической интерпретации Э.Клапейроном (1834) как КПД идеальной тепловой машины: КПД = (T 1 - T 2)/T 1 Карно и Клапейрон сформулировали закон сохранения теплорода невесомой неуничтожимой жидкости, содержание которой определяет температуру тела. Теория теплорода господствовала в термодинамике до середины XIX века, при этом законы и соотношения, выведенные на основе представлений о теплороде, оказались действительными и в рамках молекулярно-кинетической теории теплоты. Чтобы выяснить причины протекания самопроизвольных процессов, идущих без выделения тепла, возникла необходимость описать теплоту методом обобщенных сил, аналогично любой механической работе (А), через обобщенную силу (F) и обобщенную координату (в данном случае тепловую) [ 4 ]: da = Fdx Для тепловых обратимых процессов получим: dq = TdS Т.е. изначально энтропия S это тепловая координата состояния, которая введена (Рудольф Клаузиус, 1865 г.) для стандартизации математического аппарата термодинамики. Тогда для изолированной системы, где dq = 0, получим: В самопроизвольном процессе ΔS > 0 В равновесном процессе ΔS = 0 В несамопроизвольном процессе ΔS < 0 В общем случае энтропия изолированной системы или увеличивается, или остается постоянной: ΔS 0 Энтропия свойство системы в целом, а не отдельной частицы. В 1872 г. Л.Больцман [ 5 ] предложил статистическую формулировку второго закона термодинамики: изолированная система эволюционирует преимущественно в направлении большей термодинамическоой вероятности. В 1900 г. М.Планк вывел уравнение для статистического расчета энтропии: S = k b lnw W число различных состояний системы, доступное ей при данных условиях, или термодинамическая вероятность макросостояния системы. k b = R/N A = 1, эрг/град постоянная Больцмана 4. Полторак О.М., Термодинамика в физической химии. Учеб. для хим. и хим-технол. спец. вузов, М.: Высш. шк., с., стр Больцман Людвиг (Boltzmann, Ludwig) (), австрийский физик. Установил фундаментальное соотношение между энтропией физической системы и вероятностью ее состояния, доказал статистический характер II начала термодинамики Современный биограф Людвига Больцмана физик Карло Черчиньяни пишет: Только хорошо поняв второе начало термодинамики, можно ответить на вопрос, почему вообще возможна жизнь. В 1906 г. Больцман покончил с собой, поскольку обманулся в любви; он посвятил свою жизнь атомной теории, но любовь его осталась без взаимности, потому что современники не могли понять масштаб его картины мира 14

5 Следует всегда помнить, что второй закон термодинамики не является абсолютным; он теряет смысл для систем, содержащих малое число частиц, и для систем космического масштаба. Второй закон, особенно в статистической формулировке, неприменим к живым объектам, которые представляют собой открытые системы и постоянно уменьшают энтропию, создавая идеально упорядоченные молекулы, например, за счет энергии солнечного света. Для живых систем характерна самоорганизация, которую чилийский нейробиолог Умберто Матурана (Humberto Maturana) назвал в 1970 г. автопоэз (самосозидание). Живые системы не только сами постоянно удаляются от классического термодинамического равновесия, но и делают неравновесной окружающую среду. Еще в 1965 г. американский специалист по химии атмосферы Джеймс Лавлок (Lovelock) предложил в качестве критерия наличия жизни на Марсе оценивать равновесность состава атмосферы. В атмосфере Земли содержатся одновременно кислород (21% по объему), метан (0,00018%), водород (0,00005%), моноксид углерода (0,00001%) это явно неравновесная смесь при температурах С. Земная атмосфера открытая система, в формировании которой постоянно участвуют живые организмы. В атмосфере Марса преобладает углекислый газ (95% - ср. с 0,035% на Земле), кислорода в ней менее 1%, а газы-восстановители (метан) пока не обнаружены. Следовательно, атмосфера Марса практически равновесна все реакции между содержащимися в ней газами уже осуществились. Из этих данных Лавлок заключил, что в настоящее время на Марсе жизни нет Энергия Гиббса Введение энтропии дало возможность установить критерии, позволяющие определить направление и глубину протекания любого химического процесса (для большого числа частиц в равновесии). Макроскопические системы достигают равновесия, когда изменение энергии компенсируется энтропийной составляющей: При постоянном давлении и температуре: ΔH p = TΔS p или Δ(H-TS) ΔG = 0 энергия Гиббса[ 6 ] или свободная энергия Гиббса или изобарно-изотермический потенциал Изменение энергии Гиббса как критерий возможности химической реакции Для данной температуры ΔG = ΔH - TΔS При ΔG < 0 реакция возможна; при ΔG > 0 реакция невозможна; при ΔG = 0 система находится в равновесии. 6 Гиббс (Gibbs) Джозайя Уиллард (), американский физик и математик, один из основоположников химической термодинамики и статистической физики. В Гиббс опубликовал фундаментальный трактат О равновесии гетерогенных веществ (On the Equilibrium of Heterogeneous Substances), ставший основой химической термодинамики. 15

6 Возможность самопроизвольной реакции в изолированной системе определяется сочетанием знаков энергетического (энтальпийного) и энтропийного факторов: Знак ΔH Знак ΔS Возможность самопроизвольной реакции + Нет + Да Зависит от соотношения ΔH и TΔS + + Зависит от соотношения ΔH и TΔS Имеются обширные табличные данные по стандартным значениям ΔG 0 и S 0, позволяющие вычислить ΔG 0 реакции. 5. Химическая кинетика Предсказания химической термодинамики наиболее верны в своей запрещающей части. Если, например, для реакции азота с кислородом энергия Гиббса положительна: N 2 + O 2 = 2 NO ΔG 0 = +176 кдж, то эта реакция не пойдет самопроизвольно, и никакой катализатор ей не поможет. Известный заводской процесс получения NO из воздуха требует огромных затрат энергии и неравновесного проведения процесса (закалка продуктов быстрым охлаждением после пропускания смеси газов через электрическую дугу). С другой стороны, далеко не все реакции, для которых ΔG < 0, спешат осуществиться на практике. Куски каменного угля могут веками лежать на воздухе, хотя для реакции C + O 2 = CO 2 ΔG 0 = -395 кдж Предсказание скорости химической реакции, а также выяснение зависимости этой скорости от условий проведения реакции осуществляет химическая кинетика наука о химическом процессе, его механизме и закономерностях протекания во времени. Скорость химической реакции определяется как изменение концентрации одного из участвующих в реакции веществ (исходное вещество или продукт реакции) в единицу времени. Для реакции в общем виде aa + bb xx + yy скорость описывается кинетическим уравнением: v = -ΔC (A) /Δt = ΔC (X) /Δt = k C m n (A) C (B) k называется константой скорости реакции. Строго говоря, скорость определяется не как конечная разность концентраций, а как их производная v = -dc (A) /dt; степенные показатели m и n обычно не совпадают со стехиометрическими коэффициентами в уравнении реакции. Порядком реакции называется сумма всех показателей степеней m и n. Порядок реакции по реагенту A равен m. Большинство реакций являются многостадийными, даже если они описываются простыми стехиометрическими уравнениями. В этом случае обычно получается сложное кинетическое уравнение реакции. Например, для реакции H 2 + Br 2 = 2 HBr dc (HBr) /dt = kc (H2) C (Br2) 0,5 / (1 + k C (HBr) / C (Br2)) 16

7 Такая сложная зависимость скорости от концентраций говорит о многостадийном механизме реакции. Для данной реакции предложен цепной механизм: Br 2 Br. + Br. зарождение цепи Br. + H 2 HBr + H. продолжение цепи H. + Br 2 HBr + Br. продолжение цепи H. + HBr H 2 + Br. ингибирование Br. + Br. Br 2 обрыв цепи Число молекул реагентов, участвующих в простой одностадийной реакции, состоящей из одного элементарного акта, называется молекулярностью реакции. Мономолекулярная реакция: C 2 H 6 = 2 CH 3. Бимолекулярная реакция: CH 3. + CH 3. = C 2 H 6 Примеры относительно редких тримолекулярных реакций: 2 NO + O 2 = 2 NO 2 2 NO + Cl 2 = 2 NOCl H. + H. + Ar = H 2 + Ar Особенностью реакций 1-го порядка, протекающих по схеме: А продукты является постоянство времени полупревращения t 0,5 времени, в течение которого половина исходного вещества превратится в продукты. Это время обратно пропорционально константе скорости реакции k. t 0,5 = 0,693/k т.е. время полупревращения для реакции первого порядка является константой и характеристикой реакции. В ядерной физике период полураспада радиоактивного изотопа является его важным свойством Зависимость скорости реакций от температуры Большинство практически важных реакций ускоряются при нагревании. Зависимость константы скорости реакции от температуры выражается уравнением Аррениуса[ 7 ] (1889): k = Aexp(-E a /RT) Множитель A связан с частотой столкновений частиц и их ориентацией при столкновениях; E a энергия активации данной химической реакции. Для определения энергии активации данной реакции достаточно измерить ее скорость при двух температурах. Уравнение Аррениуса описывает температурную зависимость не только для простых химических процессов. Психологические исследования людей с разной температурой тела (от 36,4 до 39 о С) показали, что субъективное ощущение времени (скорость отсчета тактов) и 7 Сванте Август Аррениус (Arrhenius) () Шведский физико-химик, создатель теории электролитической диссоциации, академик шведской Королевской Академии наук. На основании представлений об образовании активных частиц в растворах электролитов Аррениус выдвинул общую теорию образования «активных» молекул при химических реакциях. В 1889 г., изучая инверсию тростникового сахара, он показал, что скорость этой реакции определяется столкновением только «активных» молекул. Резкое повышение этой скорости с ростом температуры определяется значительным увеличением при этом количества «активных» молекул в системе. Для вступления в реакцию молекулы должны обладать некоторой добавочной энергией по сравнению со средней энергией всей массы молекул вещества при определенной температуре (эта добавочная энергия будет впоследствии названа энергией активации). Аррениус наметил пути изучения природы и вида температурной зависимости констант скорости реакции. 17


8 скорость забывания случайных последовательностей знаков описываются уравнением Аррениуса с энергией активации 190 кдж/моль [ 8 ]. Положительное значение энергии активации показывает, что на пути от исходных веществ к продуктам имеется энергетический барьер, который не позволяет немедленно осуществляться всем термодинамически возможным реакциям: Рисунок 2. Энергия активации (в какой момент ее сообщают спичке?) 8. Леенсон И.А. Почему и как идут химические реакции. М.: МИРОС, с, с

Химический процесс. Почему и как идут химические реакции? Термодинамика и кинетика Химия для психологов. Лекция 3. В.В.Загорский Применение химических реакций. Тепловые машины Паровоз «Ракета» (1814) Джорджа
Элементы химической термодинамики (1) Первый закон термодинамики Лекция курса «Общая и неорганическая химия» для 11-х классов СУНЦ Джозеф Блэк (1728-1799) Теплота и температура Тепловые машины Паровоз
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ Крисюк Борис Эдуардович Основы химической термодинамики. Системой будем называть тело или группу тел, отделенных от окружающей среды реальной или мысленной границей. Система
Тема 1 Основы термодинамики (2 часа) Термодина мика (греч θέρμη «тепло», δύναμις «сила») раздел физики, изучающий соотношения и превращения теплоты и других форм энергии В отдельные дисциплины выделились
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Термодинамика это единственная физическая теория, относительно которой я уверен, что она никогда не будет опровергнута. А.Эйнштейн Термодинамика (ТД) - это наука, изучающая законы
«Основные закономерности протекания химических реакций» Лекция 3 Дисциплина «Химия 1.6» для студентов заочного отделения Лектор: к.т.н., Мачехина Ксения Игоревна * План лекции (I часть) 1. Основные понятия.
Энергетика химических превращений. 1й закон термодинамики Лекция 1 Признаки химической реакции изменение цвета появление запаха изменение вкуса выпадение осадка свечение увеличение объема выделение тепла,
Лекция 11 Основные понятия и принципы химической кинетики 1 План лекции 1. Время в физике, химии и биологии. 2. Предмет химической кинетики. Связь хим. кинетики и хим. термодинамики. 3. Основные понятия
Лекция 4. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ Самопроизвольные и несамопроизвольные процессы. «Потерянная» работа Первый закон термодинамики позволяет решить многие вопросы химии и химической технологии, связанные
Лекция 2. Второй закон термодинамики. Энтропия, энергии Гиббса и Гельмгольца. Процессы Самопроизвольные 1. Проходят без затраты работы. 2. С их помощью можно получить работу. Несамопроизвольные 1. Проходят
Термодинамические величины. Внутренняя энергия E вещества это полная энергия частиц, составляющих данное вещество. Она слагается из кинетической и потенциальной энергий частиц. Кинетическая энергия это
Термохимия и направленность химических реакций Основы термодинамики химических процессов Термодинамика Объект изучения: Энергетические изменения в физических и химических процессах (системах) Система:
Лекция 3. Закономерности протекания химических процессов Лектор: асс. каф. ОНХ Абрамова Полина Владимировна еmail: [email protected] «Термодинамика подобна старой надоедливой тетке. Она всюду сует свой нос,
Сегодня среда, 9 июля 2014 г. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ Лекция 6 Содержание лекции: *Второе начало термодинамики *Энтропия *Закон возрастания энтропии *Энтропия и вероятность *Философское значение II
Химическая кинетика ЛЕКЦИЯ 6 УСТИНОВА ЭЛЬВИРА МАРАТОВНА План лекции 1. Скорость химической реакции 2. Классификация химических реакций 3. Закон действующих масс 4. Влияние температуры на скорость химической
Education Quality Assurance Centre Институт Группа ФИО MODULE: ФИЗИКА (ТЕРМОДИНАМИКА_МОДУЛЬ 2) Ответ Вопрос Базовый билет Нас 1 2 Броуновское движение это движение 1) молекул жидкости 3) мельчайших частиц
Химическая кинетика. Скорости химических реакций.. Основные положения химической кинетики Скоростью химической реакции называется изменение количества вещества за единицу времени. При условии постоянства
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Общие представления Формирование понятий о скорости химической реакции и химическом равновесии необходимо для понимания учащимися фундаментальных законов
«Химическая термодинамика» Лекция 4 Дисциплина «Общая неорганическая химия» для студентов очного отделения Лектор: к.т.н., Мачехина Ксения Игоревна * План лекции 1. Основные понятия. 2. Первый закон термодинамики.
Лекция 1 Основы химической термодинамики 1. Основные понятия и определения Химическая термодинамика (ХТД) раздел химии, изучающий: - энергетические эффекты ХР; - возможность и направление протекания ХР;
Тема 2 1. Энергетика химических процессов. 2. Химическая кинетика и равновесие 1. Энергетика химических процессов Энергетика химических процессов рассматривается в разделе химии «Химическая термодинамика».
ХИМИЧЕСКАЯ КИНЕТИКА Основные понятия и определения Химическая кинетика это раздел химии, изучающий скорости и механизмы химических реакций 2 Основные понятия и определения Химические реакции гомогенные
Министерство образования и науки Российской Федерации Государственное образовательное учреждение Высшего профессионального образования «УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» Кафедра
ТЕРМОДИНАМИКА Лекция План лекции:. Основные положения и определения термодинамики (термодинамическая система, термодинамический процесс, параметры состояния) 2. Внутренние параметры состояния (давление,
Лекция 4 Основные положения молекулярнокинетической теории строения вещества. Термодинамические системы. Энтропия. Все вещества состоят из атомов и молекул. Атом наименьшая структурная единица химического
Московский государственный университет им.м.в.ломоносова Химический факультет Успенская И.А. Конспект лекций по физической химии (для студентов биоинженерии и биоинформатики) www.chem.msu.ru/teaching/uspenskaja/
ЗАДАНИЕ Термодинамические потенциалы. Химическое равновесие. Вариант 1 1. Запишите условие химического равновесия для реакции СН (г) + / О (г) = СО (г) + Н О (ж).. Какой знак имеет разность химических
Лекция 3 Основное уравнение молекулярно кинетической теории газов 1. Постоянная Больцмана. 2. Уравнение Клапейрона Менделеева. 3. Универсальная газовая постоянная. 4. Газовые законы. 5. Измерение температуры
12. Химические реакции. Скорость, энергетика и обратимость 12.1. Скорость реакций Количественной характеристикой быстроты течения химической реакции А + B D + E является ее скорость, т. е. скорость взаимодействия
1. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ 1.1. Превращение вещества. Взаимосвязь термодинамики и кинетики. В связи с химическими и физическими преобразованиями материи возникает два вопроса: 1) Могут ли эти преобразования
Лекция 16 Обратимые и необратимые процессы. Циклы. Понятие энтропии. Закон возрастания энтропии. Второе начало термодинамики. Третье начало термодинамики. Равновесным называется состояние, при котором
Энергия Гиббса: открытие, значение, методы измерения Васьков Е.А. КубГТУ Краснодар, Россия Gibbs energy: the opening, the importance of measuring methods Vaskov EA KubGTU Krasnodar, Russia Свободная энергия
Лекция 3 Кинетика химических реакций Цель занятия: изучить кинетику разложения пероксида водорода; определить константу скорости при различных температурах; найти энергию активации реакции. Значимость
ТЕПЛОФИЗИКА План лекции: 1. Термодинамика (основные положения и определения) 2. Внутренние параметры состояния (давление, температура, плотность). Уравнение состояния идеального газа 4. Понятие о термодинамическом
Контрольная работа 1 ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА 1. Химическая термодинамика как наука. Первый закон термодинамики, его формулировка и математическое выражение. 2. Что называется термодинамической системой?
Лекция 3. Химическое равновесие. Понятие о кинетике химических реакций. Равновесное состояние это такое состояние системы, при котором: а) еѐ интенсивные параметры не изменяются во времени (p, T, C); б)
Семинары по общей химии Л.С.Гузей Учебное пособие по общей химии для студентов геологического факультета МГУ 01г. Тема Стехиометрия. Определения и утверждения Выберите правильные (ое) определения (ие)
ХИМИЧЕСКАЯ КИНЕТИКА Химическая кинетика изучает скорости протекания химических процессов, их зависимость от различных факторов: концентрации реагирующих веществ, температуры, давления, присутствия катализаторов.
Федеральное агентство по образованию ГОУ ВПО Уральский государственный технический университет УПИ Кафедра физики ИНДИВИДУАЛЬНОЕ ДОМАШНЕЕ ЗАДАНИЕ ПО ФИЗИКЕ ТЕМА: ТЕРМОДИНАМИКА ИДЕАЛЬНОГО ГАЗА МЕТОДИЧЕСКИЕ
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА План лекции:. Константа равновесия химической реакции. Тепловой закон Нернста Лекция 6. КОНСТАНТА РАВНОВЕСИЯ ХИМИЧЕСКОЙ РЕАКЦИИ Рассмотрим случай гомогенной химической реакции,
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА План лекции:. Введение. Основные положения термодинамики (термодинамическая система, термодинамический процесс). Параметры состояния (давление, температура, плотность) 4. Уравнение
Лекция 4 Почему и как идут химические реакции 1 План лекции 1. Классификация химических реакций. 2. Стехиометрическое описание химической реакции. 3. Энергетическая кривая элементарной химической реакции.
Химия 1.2 Лекция 5. Химическое равновесие. Химическая кинетика. Лектор: асс. каф. ОХХТ к.х.н. Абрамова Полина Владимировна еmail: [email protected] «Химия может открыть определенную последовательность даже
Биологический факультет (Специальность биофизика) Факультет биоинженерии и биоинформатики 2006/2007 Общая и неорганическая химия ЛЕКЦИИ Лекция 3. Элементы химической термодинамики и химической кинетики
Лекция 2. ОСНОВЫ ТЕРМОДИНАМИКИ Основные понятия Термодинамика является феноменологической теорией макроскопических систем, поэтому вcе её основные понятия берутся непосредственно из эксперимента. Термодинамическая
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА План лекции: 1. Техническая термодинамика (основные положения и определения) 2. Внутренние параметры состояния (давление, температура, плотность). Понятие о термодинамическом
3.. Работа и количество тепла. 3... Работа внешних сил и работа тела. Запишем работу da, совершаемую внешней силой -F x (минус означает, что внешняя сила направлена против внутренних сил давления газа)
1 МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА Основные положения и определения Два подхода к изучению вещества Вещество состоит из огромного числа микрочастиц - атомов и молекул Такие системы называют макросистемами
Экз. билета 1 1. Ковалентная связь. Правило октета. Структуры Льюиса. 2. Давление пара над идеальным раствором. Закон Рауля. Предельно разбавленные растворы. Закон Генри. 3. Гетерогенный катализ: основные
Общие закономерности химических процессов ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ Основные понятия и определения Химическая термодинамика это раздел химии, изучающий взаимные превращения различных форм энергии при
Лекция 1 Основной закон химической кинетики. Е. стр.7-22. Р. стр. 9-19, 23-26, 44-48. Э.-К. стр. 48-57, 70-73 Химическая реакция и химическое равновесие с точки зрения термодинамики. Скоростью химической
ХИМИЯ Лекция 03 Как и почему происходят химические реакции. Термохимия Е.А. Ананьева, к.х.н., доцент, кафедра «Общая Химия» НИЯУ МИФИ Почему идут химические реакции Предсказание возможности осуществления
План лекции: ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА Лекция 2. Уравнение состояния идеального газа 2. Уравнение состояния реальных газов и жидкостей 3. Газовые смеси. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА Как известно,
Лекция 2 Равновесное состояние химических систем 2.1 Основные теоретические положения Различают обратимые и необратимые физические процессы и химические реакции. Для обратимых процессов существует состояние
Лекция 6-7 Основы химической термодинамики Основные понятия и определения Химическая термодинамика - это наука, изучающая превращения различных форм энергии при химических реакциях и устанавливающая законы
Химическая термодинамика Пример 1. Известны тепловые эффекты следующих реакций (1) и () при 7 К и постоянном давлении 11, кпа. Рассчитать при тех же условиях тепловой эффект реакции (). (1) C O CO, ()
Вариант 1. 1. Можно ли использовать статистические методы при изучении поведения микроскопических тел? Почему? 2. Может ли единичная молекула находиться в состоянии термодинамического равновесия? 3. Если
Лабораторная работа. Определение константы скорости инверсии сахарозы. Химическая кинетика изучает скорости протекания химических процессов, их зависимость от различных факторов: концентрации реагирующих
Лекция 9 ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ. НЕРАВЕНСТВО КЛАУЗИУСА Термины и понятия Вечный двигатель Возрастание Второго рода Направление процесса Необратимый процесс Необратимый цикл Неравенство Клаузиуса Обратимый
Хими ческая реаќция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). Лекция 10 Существует большое количество
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ Крисюк Борис Эдуардович Химическая кинетика. Формальная кинетика. Для реакции A + B C ее скорость v есть: v = - d[a]/dt = - d[b]/dt = d[c]/dt В общем случае для реакции aa
ХИМИЧЕСКАЯ КИНЕТИКА Химическая кинетика изучает скорость и механизм химических реакций. Все реакции по механизму протекания можно разделить на простые (элементарные), протекающие в одну стадию, и сложные,
Лекция 11 Кинетическая теория идеальных газов. Давление и температура. Опытные законы идеального газа. Молекулярно - кинетическая теория раздел физики, изучающий свойства вещества на основе представлений
Л15 Закон сохранения энергии в открытых системах замкнутая система внутренняя энергия U энтропия S(U) k lnw (U) температура ds 1 du Из-за отсутствия контактов с внешней средой внутренняя энергия в этом
Термодинамика – наука о превращении одних форм энергии в другие на основе закона сохранения энергии. Термодинамика устанавливает направление самопроизвольного течения химических реакций при данных условиях. При химических реакциях рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Сумма энергий связей после реакции не равна сумме энергий связи до реакции, т.е. протекание химической реакции сопровождается выделением или поглощением энергии, причем формы ее различны.
Термохимия – раздел термодинамики, посвященный изучению тепловых эффектов реакций. Тепловой эффект реакции, измеренный при постоянных температуре и давлении, называют энтальпией реакции и выражают в джоулях (Дж) и килоджоулях (кДж).
Для экзотермических реакций , для эндотермических - . Энтальпию образования 1моль данного вещества из простых веществ, измереного при температуре 298 К (25 °С) и давлении 101,825 кПа (1 атм), называют стандартной (кДж/моль). Энтальпии простых веществ условно принимают равными нулю.
В основе термохимических расчетов лежит закон Гесса: тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода. Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект химической реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции:
В термохимических уравнениях указывают значение энтальпии химической реакции . При этом у формулы каждого вещества указывают его физическое состояние: газообразное (г), жидкое (ж), твердое кристаллическое (к).
В термохимических уравнениях тепловые эффекты реакций дают в расчете на 1 моль исходного или конечного вещества. Поэтому здесь допускаются дробные коэффициенты. При химических реакциях проявляется диалектический закон единства и борьбы противоположностей. С одной стороны система стремится к упорядочению (агрегации) – уменьшению Н, а с другой стороны – к беспорядку (дезагрегации). Первая тенденция растет с понижением температуры, а вторая – с её повышением. Тенденцию к беспорядку характеризует величина, названная энтропией S [Дж/(моль. К)]. Она является мерой неупорядоченности системы. Энтропия пропорциональна количеству вещества и возрастает с увеличением движения частиц при нагревании, испарении, плавлении, расширении газа, ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т.п. – ведут к уменьшению энтропии. Энтропия – функция состояния, т.е.
Общая движущая сила процесса складывается из двух сил: стремление к упорядочению и стремления к беспорядку . При p = const и T = const общую движущую силу процесса можно представить следующим образом:
![]()
Энергия Гиббса , или изобарно-изотермический потенциал, также подчиняется следствию закона Гесса:
Самопроизвольно протекают процессы, идущие в сторону уменьшения любого потенциала и, в частности, в сторону уменьшения . При состоянии равновесия температура начала равновесной реакции равна:
Таблица 5
Стандартные энтальпии образования , энтропии и энергии Гиббса образования некоторых веществ при 298 К (25°С)
| Вещество | , кДж/моль | , Дж/моль | , кДж/моль |
| CaO (к) | -635,5 | 39,7 | -604,2 |
| CaCO 3 (к) | -1207,0 | 88,7 | -1127,7 |
| Ca(OH) 2 (к) | -986,6 | 76,1 | -896,8 |
| H 2 O (ж) | -285,8 | 70,1 | -237,3 |
| H 2 O (г) | -241,8 | 188,7 | -228,6 |
| Na 2 O (к) | -430,6 | 71,1 | -376,6 |
| NaOH (к) | -426,6 | 64,18 | -377,0 |
| H 2 S (г) | -21,0 | 205,7 | -33,8 |
| SO 2 (г) | -296,9 | 248,1 | -300,2 |
| SO 3 (г) | -395,8 | 256,7 | -371,2 |
| C 6 H 12 O 6 (к) | -1273,0 | - | -919,5 |
| C 2 H 5 OH (ж) | -277,6 | 160,7 | -174,8 |
| CO 2 (г) | -393,5 | 213,7 | -394,4 |
| CO(г) | -110,5 | 197,5 | -137,1 |
| C 2 H 4 (г) | 52,3 | 219,4 | 68,1 |
| CH 4 (г) | -74,9 | 186,2 | -50,8 |
| Fe 2 O 3 (к) | -822,2 | 87,4 | -740,3 |
| FeO (к) | -264,8 | 60,8 | -244,3 |
| Fe 3 O 4 (к) | -1117,1 | 146,2 | -1014,2 |
| CS 2 (г) | 115,3 | 65,1 | 237,8 |
| P 2 O 5 (к) | -1492 | 114,5 | -1348,8 |
| NH 4 Cl (к) | -315,39 | 94,56 | -343,64 |
| HCl (г) | -92,3 | 186,8 | -95,2 |
| NH 3 (г) | -46,2 | 192,6 | -16,7 |
| N 2 O (г) | 82,0 | 219,9 | 104,1 |
| NO (г) | 90,3 | 210,6 | 86,6 |
| NO 2 (г) | 33,5 | 240,2 | 51,5 |
| N 2 O 4 (г) | 9,6 | 303,8 | 98,4 |
| CuO (к) | -162,0 | 42,6 | -129,9 |
| H 2 (г) | 130,5 | ||
| C (графит) | 5,7 | ||
| O 2 (г) | 205,0 | ||
| N 2 (г) | 181,5 | ||
| Fe (к) | 27,15 | ||
| Cl 2 (г) | 222,9 | ||
| KNO 3 (к) | -429,71 | 132,93 | -393,13 |
| KNO 2 (к) | -370,28 | 117,15 | -281,58 |
| K 2 O (к) | -361,5 | 87,0 | -193,3 |
| ZnO (к) | -350,6 | 43,6 | -320,7 |
| Al 2 O 3 (к) | -1676,0 | 50,9 | -1582,0 |
| PCl 5 (г) | -369,45 | 362,9 | -324,55 |
| PCl 3 (г) | -277,0 | 311,7 | -286,27 |
| H 2 O 2 (ж) | -187,36 | 105,86 | -117,57 |
Скорость реакции определяется природой и концентрацией реагирующих веществ и зависит от температуры и катализатора.
Закон действия масс: При постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ в степени их стехиометрических коэффициентов.
Для реакции аА + вВ = сС + dD скорость прямой реакции:
![]() ,
,
скорость обратной реакции: ![]() , где - концентрации растворенных или газообразных соединений, моль/л;
, где - концентрации растворенных или газообразных соединений, моль/л;
a, b, c, d – стехиометрические коэффициенты в уравнении;
К – константа скорости.
В выражении для скорости реакции не включают концентрации твердых фаз.
Влияние температуры на скорость реакции описывается правилом Вант-Гоффа: при нагревании на каждые 10 градусов скорость реакции возрастает в 2-4 раза.
Скорость реакции при температурах t 1 и t 2 ;
Температурный коэффициент реакции.
Большинство химических реакций являются обратимыми:
аА + вВ сС + dD
отношение констант скоростей – величина постоянная, называемая константой равновесия
![]() К р = const при T = const.
К р = const при T = const.
Принцип Ле – Шателье: Если на систему, находящуюся в состоянии химического равновесия, оказать какое – либо воздействие (изменить температуру, давление или концентрацию), то система будет реагировать таким образом, чтобы уменьшить приложенное воздействие:
а) при повышении температуры в равновесных системах равновесие смещается в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции;
б) при повышении давления равновесие смещается в сторону меньших объемов, а при понижении давления – в сторону больших объемов;
в) при повышении концентрации равновесие смещается в сторону ее уменьшения.
Пример 1. Определите стандартное изменение энтальпии реакции:
Экзо- или эндотермическая данная реакция?
Решение: Стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ
При каждом суммировании следует учитывать в соответствии с уравнением реакции, число молей участвующих в реакции веществ. Стандартные энтальпии образования простых веществ равны нулю:
Согласно табличным данным:
Реакции, которые сопровождаются выделением теплоты, называются экзотермическими, а те, которые сопровождаются поглощением теплоты, - эндотермическими. При постоянных температуре и давлении изменение энтальпии химической реакции равно по величине, но обратно по знаку ее тепловому эффекту. Поскольку стандартное изменение энтальпии данной химической реакции , то делаем вывод, что данная реакция является экзотермической.
Пример 2. Реакция восстановления Fe 2 O 3 водородом протекает по уравнению:
Fe 2 O 3(K) + 3H 2(Г) = 2Fe (K) + 3H 2 O (Г)
Возможна ли эта реакция при стандартных условиях?
Решение: Для ответа на этот вопрос задачи нужно вычислить стандартное изменение энергии Гиббса реакции . В стандартных условиях:
Суммирование производят с учетом числа моделей, участвующих в реакции веществ, образования наиболее устойчивой модификации простого вещества принимают равной нулю.
С учетом выше сказанного
Согласно табличным данным:

Самопроизвольно протекающие процессы идут в сторону уменьшения . Если < 0, процесс принципиально осуществим, если > 0, процесс самопроизвольно проходить не может.
Следовательно, данная реакция при стандартных условиях невозможна.
Пример 3. Написать выражения закона действия масс для реакций:
а) 2NO (Г) + Cl 2(Г) = 2NOCl (Г)
б) CaCO 3(K) = CaO (K) + CO 2(Г)
Решение: Согласно закону действия масс скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам:
а) V = k 2 .
б) Поскольку карбонат кальция - твердое вещество, концентрация которого не изменяется в ходе реакции, искомое выражение будет иметь вид:
V = k, т.е. в данном случае скорость реакции при определенной температуре постоянна.
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению:
PCl 5(Г) = PCl 3(Г) + Cl 2(Г) ; ![]()
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложение PCl 5 ? Напишите математическое выражение скорости прямой и обратной реакций, а также константы равновесия.
Решение: Смещением или сдвигом химического равновесия называют изменения равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции.
Смещение химического равновесия подчиняется принципу Ле-Шателье, согласно которому изменение одного из условий, при которых система находится в равновесии, вызывает смещение равновесия в направлении той реакции, которая противодействует производному изменению.
а) Так как реакция разложения PCl 5 эндотермическая , то для смещения равновесия в сторону прямой реакции нужно повысить температуру.
б) Так как в данной системе разложение PCl 5 ведет к увеличению объема (из одной молекулы газа образуется две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление.
в) Смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl 5 , так и уменьшением концентрации PCl 3 или Cl 2 .
Согласно закону действия масс, скорости прямой (V 1) и обратной (V 2) реакций выражаются уравнениями:
V 2 = k
Константа равновесия данной реакции выражается уравнением:
![]()
Контрольные задания:
81 - 100. а) рассчитайте стандартное изменение энтальпии прямой реакции и определите экзо- или эндотермическая это реакция;
б) определите изменение энергии Гиббса прямой реакции и сделайте вывод о возможности её осуществления при стандартных условиях;
в) напишите математическое выражение скорости прямой и обратной реакции, а также константы равновесия;
г) как следует изменить условия, чтобы равновесие процесса сместить вправо?
81. CH 4(г) + CO 2(г) = 2СO (г) + 2H 2(г)
82. FeO (K) + CO (г) =Fe (K) + CO 2(г)
83. C 2 H 4(г) + O 2(г) = CO 2(г) + H 2 O (г)
84. N 2(г) + 3H 2(г) =2NH 3(г)
85. H 2 O (г) +CO (г) = CO 2(г) +H 2(г)
86. 4HCl (г) + O 2(г) = 2H 2 O (г) + 2Cl 2(г)
87. Fe 2 O 3(К) +3H 2(г) = 2Fe (K) + 3H 2 O (г)
88. 2SO 2(г) + O 2(г) = 2SO 3(г)
89. PCl 5(г) = PCl 3(г) + Cl 2(г)
90. CO 2(г) + C (графит) = 2СO (г)
91. 2H 2 S (г) + 3O 2(г) = 2SO 2(г) + H 2 O (г)
92. Fe 2 O 3(K) +CO (г) =2FeO (K) + CO 2(г)
93. 4NH 3(г) + 5O 2(г) = 4NO (г) + 6H 2 O (г)
94. NH 4 Cl (K) = NH 3(г) + HCl (г)
95. CH 4(г) + 2O 2(г) = CO 2(г) + 2H 2 O (г)
96. CS 2(г) + 3O 2(г) = CO 2(г) + 2SO 2(г)
97. 4HCl (г) + O 2(г) = 2Cl 2(г) + 2H 2 O (г)
98. 2NO (г) + O 2(г) = N 2 O 4(г)
99. NH 3(г) + HCl (г) = NH 4 Cl (K)
100. CS 2(г) + 3O 2(г) = 2Cl 2(г) + 2SO 2(г)
Тема 6: Растворы. Способы выражения концентрации растворов
Растворы – это гомогенные системы, состоящие из растворителя, растворенных веществ и возможных продуктов их взаимодействия. Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя.
Способы выражения концентрации растворов:
Массовая доля () показывает количество граммов растворенного вещества в 100 г раствора:
где т – масса растворенного вещества (г), т 1 – масса раствора (г).
Молярная концентрация показывает число молей растворенного вещества, содержащихся в 1л раствора:
где М- молярная масса вещества (г/моль), V- объем раствора (л).
Моляльная концентрация показывает число молей растворенного вещества, содержащихся в 1000г растворителя:п 101-120. Найти массовую долю, молярную концентрацию, моляльную концентрацию для следующих растворов:
| Вариант | Вещество (х) | Масса вещества (х) | Объем воды | Плотность раствора |
| CuSO 4 | 320 г | 10 л | 1,019 | |
| NaCl | 0,6 г | 50 мл | 1,071 | |
| H 2 SO 4 | 2 г | 100 мл | 1,012 | |
| Na 2 SO 4 | 13 г | 100 мл | 1,111 | |
| HNO 3 | 12,6 г | 100 мл | 1,066 | |
| HCl | 3,6 кг | 10 кг | 1,098 | |
| NaOH | 8 г | 200 г | 1,043 | |
| MgCl 2 | 190 г | 810 г | 1,037 | |
| KOH | 224 г | 776 г | 1,206 | |
| CuCl 2 | 13,5 г | 800 мл | 1,012 | |
| HCl | 10,8 г | 200 г | 1,149 | |
| CuSO 4 | 8 г | 200 мл | 1,040 | |
| NaCl | 6,1 г | 600 мл | 1,005 | |
| Na 2 SO 3 | 4,2 г | 500 мл | 1,082 | |
| H 2 SO 4 | 98 г | 1000 мл | 1,066 | |
| ZnCl 2 | 13,6 г | 100 мл | 1,052 | |
| H 3 PO 4 | 9,8 г | 1000 мл | 1,012 | |
| Ba(OH) 2 | 100 г | 900 г | 1,085 | |
| H 3 PO 4 | 29,4 г | 600 мл | 1,023 | |
| NaOH | 28 г | 72 г | 1,309 |
Решение задач по разделу
Тема «Химическая термодинамика и кинетика», предполагающая изучение условий, влияющих на скорость химической реакции, встречается в школьном курсе химии дважды – в 9-м и в 11-м классах. Однако именно эта тема является одной из наиболее трудных и достаточно сложной не только для понимания «средним» учеником, но даже для изложения некоторыми учителями, особенно неспециалистами, работающими в сельской местности, для которых химия является дополнительным предметом, с учетом часов которого у педагога набирается ставка, а значит, и надежда на более-менее приличную зарплату.
В условиях резкого уменьшения числа учащихся в сельских школах, в силу хорошо известных причин, учитель вынужден быть универсалом. Посетив 2–3 курса, он начинает преподавание предметов, зачастую очень далеких от его основной специальности.
Данная разработка ориентирована в первую очередь на начинающих учителей и предметников, вынужденных преподавать химию в условиях рыночной экономики. Материал содержит задачи на нахождение скоростей гетерогенных и гомогенных реакций и увеличения скорости реакции при повышении температуры. Несмотря на то, что данные задачи базируются на школьном, хотя и сложном для усвоения «средним» учеником материале, целесообразно прорешать несколько из них на уроке химии в
11-м классе, а остальные предложить на кружковом или факультативном занятии учащимся, которые планируют свою дальнейшую судьбу связать с химией.
Помимо подробно разобранных и снабженных ответами задач данная разработка содержит теоретический материал, который поможет учителю химии, в первую очередь неспециалисту, понять суть этой сложной темы курса общей химии.
С опорой на предлагаемый материал можно создать свой вариант урока-лекции, в зависимости от способностей учащихся в классе, причем использовать предложенную теоретическую часть можно при изучении этой темы как в 9-м, так и в 11-м классе.
Наконец, материал, содержащийся в данной разработке, будет нелишним разобрать самостоятельно выпускнику, готовящемуся к поступлению в вуз, в том числе и в тот, в котором химия является профилирующим предметом.
Теоретическая часть по теме
«Химическая термодинамика и кинетика»
Условия, влияющие на скорость химической реакции
1. Скорость химической реакции зависит от природы реагирующих веществ.
П р и м е р ы.
Металлический натрий, имеющий щелочную природу, бурно реагирует с водой с выделением большого количества теплоты, в отличие от цинка, имеющего амфотерную природу, который реагирует с водой медленно и при нагревании:
Порошкообразное железо более энергично взаимодействует с сильной минеральной соляной кислотой, чем со слабой органической уксусной кислотой:

2. Скорость химической реакции зависит от концентрации реагирующих веществ, находящихся в растворенном или газообразном состоянии.
П р и м е р ы.
В чистом кислороде сера горит более энергично, чем на воздухе:

С 30%-м раствором соляной кислоты порошкообразный магний реагирует более энергично, чем с 1%-м ее раствором:

3. Скорость химической реакции прямо пропорциональна площади поверхности реагирующих веществ, находящихся в твердом агрегатном состоянии.
П р и м е р ы.
Кусок древесного угля (углерод) очень трудно поджечь спичкой, но древесная угольная пыль сгорает со взрывом:
С + О 2 = СО 2 .
Алюминий в виде гранулы не реагирует с кристаллом йода количественно, но измельченный йод энергично соединяется с алюминием в виде пудры:

4. Скорость химической реакции зависит от температуры, при которой происходит процесс.
П р и м е р.
При повышении температуры на каждые 10 °С скорость большинства химических реакций увеличивается в 2–4 раза. Конкретное увеличение скорости химической реакции определяется особым температурным коэффициентом (гамма).
Рассчитаем, во сколько раз возрастет скорость реакции:
2NO + O 2 = 2NO 2 ,
если температурный коэффициент равен 3, а температура процесса возросла с 10 °С до 50 °С.
Изменение температуры составляет:
t = 50 °С – 10 °С = 40 °С.
Используем формулу:
![]()
где – скорость химической реакции при повышенной температуре, – скорость химической реакции при начальной температуре.
Следовательно, скорость химической реакции при повышении температуры с 10 °С до 50 °С возрастет в 81 раз.
5. Скорость химической реакции зависит от присутствия некоторых веществ.
Катализатор – это вещество, ускоряющее ход химической реакции, но само в процессе реакции не расходующееся. Катализатор понижает активационный барьер химической реакции.
Ингибитор – это вещество, замедляющее ход химической реакции, но само в процессе реакции не расходующееся.
П р и м е р ы.
![]()
Катализатором, ускоряющим ход данной химической реакции, является оксид марганца(IV).
Катализатором, ускоряющим ход данной химической реакции, является красный фосфор.
Ингибитором, замедляющим ход данной химической реакции, является вещество органической природы – уротропин (гексаметилентетрамин).
Скорость гомогенной химической реакции измеряется числом молей вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени в единице объема:
![]()
где гомог
– скорость химической реакции в гомогенной
системе, – число
молей одного из вступивших в реакцию или одного
из образовавшихся в результате реакции веществ, V
– объем,
t
– время, – изменение числа молей
вещества за время реакции t
.
Поскольку отношение числа молей вещества к объему системы представляет собой концентрацию с , то
Следовательно:

Скорость гомогенной химической реакции измеряется в моль/(л с).
Учитывая это, можно дать следующее определение:
скорость гомогенной химической реакции равна изменению концентрации одного из вступивших в реакцию или одного из образующихся в результате реакции веществ в единицу времени.
Если реакция протекает между веществами в гетерогенной системе, то реагирующие вещества соприкасаются между собой не во всем объеме, а только на поверхности твердого тела. Так, например, при горении кусочка кристаллической серы молекулы кислорода реагируют только с теми атомами серы, которые находятся на поверхности кусочка. При измельчении кусочка серы площадь реагирующей поверхности возрастает, и скорость горения серы увеличивается.
В связи с этим определение скорости гетерогенной химической реакции следующее:
скорость гетерогенной химической реакции измеряется числом молей вещества, вступившего в реакцию или образовавшегося в результате реакции в единицу времени на единице поверхности:
![]()
где S – площадь поверхности.
Скорость гетерогенной химической реакции измеряется в моль/(см 2 с).
Задачи по теме
«Химическая термодинамика и кинетика»
1. В сосуд для проведения химических реакций ввели 4 моль оксида азота(II) и избыток кислорода. Через 10 с количество вещества оксида азота(II) оказалось равным 1,5 моль. Найдите скорость данной химической реакции, если известно, что объем сосуда равен 50 л.
2. Количество вещества метана в сосуде для проведения химических реакций равно 7 моль. В сосуд ввели избыток кислорода и смесь взорвали. Опытным путем было установлено, что через 5 с количество вещества метана уменьшилось в 2 раза. Найдите скорость данной химической реакции, если известно, что объем сосуда равен 20 л.
3. Начальная концентрация сероводорода в сосуде для сжигания газов была равна 3,5 моль/л. В сосуд ввели избыток кислорода и смесь взорвали. Через 15 с концентрация сероводорода составила 1,5 моль/л. Найдите скорость данной химической реакции.
4. Начальная концентрация этана в сосуде для сжигания газов была равна 5 моль/л. В сосуд ввели избыток кислорода и смесь взорвали. Через 12 с концентрация этана составила 1,4 моль/л. Найдите скорость данной химической реакции.
5. Начальная концентрация аммиака в сосуде для сжигания газов была равна 4 моль/л. В сосуд ввели избыток кислорода и смесь взорвали. Через 3 с концентрация аммиака составила 1 моль/л. Найдите скорость данной химической реакции.
6. Начальная концентрация оксида углерода(II) в сосуде для сжигания газов была равна 6 моль/л. В сосуд ввели избыток кислорода и смесь взорвали. Через 5 с концентрация оксида углерода(II) уменьшилась вдвое. Найдите скорость данной химической реакции.
7. Кусочек серы с площадью реагирующей поверхности 7 см 2 сожгли в кислороде с образованием оксида серы(IV). За 10 с количество вещества серы уменьшилось с 3 моль до 1 моль. Найдите скорость данной химической реакции.
8. Кусочек углерода с площадью реагирующей поверхности 10 см 2 сожгли в кислороде с образованием оксида углерода(IV). За 15 с количество вещества углерода уменьшилось с 5 моль до 1,5 моль. Найдите скорость данной химической реакции.
9.
Кубик магния с общей площадью реагирующей
поверхности 15 см 2 и количеством вещества
6 моль сожгли в избытке кислорода. При этом через 7
с после начала реакции количество вещества
магния оказалось равным 2 моль. Найдите скорость
данной химической реакции.
10. Брусок из кальция с общей площадью реагирующей поверхности 12 см 2 и количеством вещества 7 моль сожгли в избытке кислорода. При этом через 10 с после начала реакции количество вещества кальция оказалось в 2 раза меньше. Найдите скорость данной химической реакции.
Решения и ответы
1 (NO) = 4 моль,
О 2 – избыток,
t 2 = 10 c,
t 1 = 0 c,
2 (NO) = 1,5 моль,
Найти:
Решение
2NO + О 2 = 2NO 2 .
Используя формулу:
![]()
Р-ции = (4 – 1,5)/(50 (10 – 0)) = 0,005 моль/(л с).
Ответ . р-ции = 0,005 моль/(л с).
2.
1 (CH 4) = 7 моль,
О 2 – избыток,
t 2 = 5 c,
t 1 = 0 c,
2 (CH 4) = 3,5 моль,
Найти :
Решение
CH 4 + 2О 2 = СО 2 + 2Н 2 О.
Используя формулу:
![]()
найдем скорость данной химической реакции:
Р-ции = (7 – 3,5)/(20 (5 – 0)) = 0,035 моль/(л с).
Ответ . р-ции = 0,035 моль/(л с).
3.
с 1 (H 2 S) = 3,5 моль/л,
О 2 – избыток,
t 2 = 15 c,
t 1 = 0 c,
с 2 (H 2 S) = 1,5 моль/л.
Найти:
Решение
2H 2 S + 3О 2 = 2SО 2 + 2Н 2 О.
Используя формулу:

найдем скорость данной химической реакции:
Р-ции = (3,5 – 1,5)/(15 – 0) = 0,133 моль/(л с).
Ответ . р-ции = 0,133 моль/(л с).
4.
с 1 (С 2 H 6) = 5 моль/л,
О 2 – избыток,
t 2 = 12 c,
t 1 = 0 c,
c 2 (С 2 H 6) = 1,4 моль/л.
Найти:
Решение
2С 2 H 6 + 7О 2 = 4СО 2 + 6Н 2 О.
найдем скорость данной химической реакции:
Р-ции = (6 – 2)/(15 (7 – 0)) = 0,0381 моль/(см 2 с).
Ответ . р-ции = 0,0381 моль/(см 2 с).
10. Ответ. р-ции = 0,0292 моль/(см 2 с).
Литература
Глинка Н.Л. Общая химия, 27-е изд. Под ред. В.А.Рабиновича. Л.: Химия, 1988; Ахметов Н.С. Общая и неорганическая химия. М.: Высш. шк., 1981; Зайцев О.С. Общая химия. М.: Высш. шк, 1983; Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. М.: Высш. шк., 1981; Корольков Д.В. Основы неорганической химии. М.: Просвещение, 1982; Некрасов Б.В. Основы общей химии. 3-е изд., М.: Химия, 1973; Новиков Г.И. Введение в неорганическую химию. Ч. 1, 2. Минск: Вышэйш. шк., 1973–1974; Щукарев С.А . Неорганическая химия. Т. 1, 2. М.: Высш. шк., 1970–1974; Шретер В., Лаутеншлегер К.-Х., Бибрак Х. и др. Химия. Справочное изд. Пер. с нем. М.: Химия, 1989; Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. Учебник для 9 класса средней школы. М.: Просвещение, 1990; Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. Учебник для 9 класса средней школы. М.: Просвещение, 1992.
Последние материалы сайта
Пушкин А.С.

Правила поведения на уроке физкультуры
Уроки по физической культуре всегда связаны с повышенным риском травматизма. Это накладывает на учителя по физкультуре высокие требования к исполнению техники безопасности. Преподаватель, а также каждый ученик должны неукоснительно придерживаться установл
Успенский Э.Н.

Презентация на тему: "9 мая – День Победы!
День Победы — один из самых важных праздников в странах постсоветского пространства, именно в этот день мы празднуем победу на фашистами и окончание Великой Отечественной войны, унесшей жизни множества наших соотечественников. Также День Победы отмечается
Сутеев В.Г.
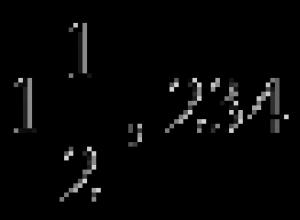
Смешанные числа Как выделить часть из дроби
В этой статье мы поговорим про смешанные числа . Сначала дадим определение смешанных чисел и приведем примеры. Дальше остановимся на связи между смешанными числами и неправильными дробями. После этого покажем, как перевести смешанное число в неправильную
Автор неизвестен

Армения Древняя: история, даты, культура
История Древней Армении насчитывает не одну тысячу лет, а сами армяне жили задолго до возникновения наций современной Европы. Они существовали и до появления античных народов - римлян и эллинов.Первые упоминанияВ клинописях персидских правителей встречает